题目内容
【题目】某工厂用软锰矿![]() 主要为
主要为![]() ,含杂质
,含杂质![]() 和闪锌矿
和闪锌矿![]() 主要为ZnS,含杂质
主要为ZnS,含杂质![]() 共同生产干电池的原料Zn和
共同生产干电池的原料Zn和![]() ,同时获得一些副产品,工艺流程如下:
,同时获得一些副产品,工艺流程如下:
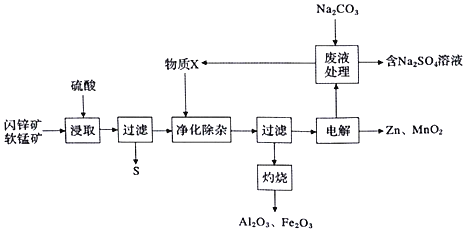
已知:硫酸浸取液的主要成分为![]() 、
、![]() 、
、![]() 、
、![]()
![]() “浸取“时发生的反应中,还原产物为______
“浸取“时发生的反应中,还原产物为______![]() 填化学式
填化学式![]()
![]() “净化除杂”时,加入的物质X可能为______
“净化除杂”时,加入的物质X可能为______![]() 填选项字母
填选项字母![]()
A.![]() B.
B.![]()
![]()
![]()
![]() “电解”时,发生反应的化学方程式为______
“电解”时,发生反应的化学方程式为______
![]() 从
从![]() ,溶液中得到芒硝晶体
,溶液中得到芒硝晶体![]() ,需要进行的实验操作有______、______过滤、洗涤、干燥等
,需要进行的实验操作有______、______过滤、洗涤、干燥等
![]() 和
和![]() 的传统生产工艺主要经历矿石焙烧、硫酸浸出、电解等过程,与传统工艺相比,该工艺流程的优点为______
的传统生产工艺主要经历矿石焙烧、硫酸浸出、电解等过程,与传统工艺相比,该工艺流程的优点为______
![]() 已知:
已知:![]() 的电离常数
的电离常数![]() ,
,![]() ,
,![]() 的pH______
的pH______![]() 填“或“
填“或“![]() ”
”![]() 在废水处理领域中常用
在废水处理领域中常用![]() 将
将![]() 转化为MnS除去,向含有
转化为MnS除去,向含有![]() 废水中通人一定量的
废水中通人一定量的![]() 气体,调节溶液的
气体,调节溶液的![]() ,当
,当![]() 浓度为
浓度为![]() 时,
时,![]() 开始沉淀,则
开始沉淀,则![]() ______。
______。![]() 已知:
已知:![]()
【答案】![]()
![]()
![]() 蒸发浓缩 冷却结晶 无二氧化硫污染性气体生成,废液可以循环利用,原料利用率高等
蒸发浓缩 冷却结晶 无二氧化硫污染性气体生成,废液可以循环利用,原料利用率高等 ![]() 5
5
【解析】
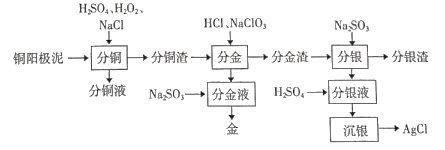
软锰矿(主要为MnO2,含杂质Al2O3)和闪锌矿(主要为ZnS,含杂质FcS)共同生产干电池的原料Zn和MnO2,闪锌矿和软锰矿加入硫酸浸取,浸取液的主要成分为ZnSO4、MnSO4、Fe2(SO4)3、Al2(SO4)3,过滤得到硫单质,滤液加入物质X是调节溶液pH沉淀铁离子和铝离子,但不能引入杂质离子,过滤得到滤渣氢氧化铁和氢氧化铝,灼烧得到氧化铁和氧化铝,滤液电解得到锌和二氧化锰,加入碳酸钠处理时剩余废液,生成的碳酸锰和碳酸锌循环使用,同时得到硫酸钠溶液浓缩蒸发、冷却结晶、过滤洗涤、干燥得到硫酸钠晶体;
(1)“浸取“时发生的反应中,生成ZnSO4、MnSO4、Fe2(SO4)3、Al2(SO4)3,锰元素化合价+4价变化为+2价被还原得到还原产物;
(2)“净化除杂”时,加入的物质X是调节溶液pH沉淀铁离子和铝离子,但不能引入新的杂质;
(3)“电解”时,生成锌和二氧化锰,说明是电解的硫酸锰和硫酸锌溶液;
(4)溶液中得到溶质固体浓缩蒸发、冷却结晶、过滤洗涤、干燥得到;
(5)反应都需要在高温下进行,因此都需要消耗大量的能量;同时有SO2生成会污染环境;而现在新工艺过程中,消耗的能量较小,而且不产生有毒的二氧化硫气体,有利于环保,废液循环利用原理利用率高等;
(6)已知:H2S 的电离常数 K1=1.0×10-7,K2=7.0×l0-15,0.1 mol/L NaHS 的pH比较HS-离子水解常数和电离平衡常数大小判断,当Qc=Ksp(MnS)时开始沉淀,由此求出硫离子的浓度,结合此时的pH,以及Ksp=c(Mn2+)c(S2-)进行计算。
软锰矿![]() 主要为
主要为![]() ,含杂质
,含杂质![]() 和闪锌矿
和闪锌矿![]() 主要为ZnS,含杂质
主要为ZnS,含杂质![]() 共同生产干电池的原料Zn和
共同生产干电池的原料Zn和![]() ,闪锌矿和软锰矿加入硫酸浸取,浸取液的主要成分为
,闪锌矿和软锰矿加入硫酸浸取,浸取液的主要成分为![]() 、
、![]() 、
、![]() 、
、![]() ,过滤得到硫单质,滤液加入物质X是调节溶液pH沉淀铁离子和铝离子,但不能引入杂质离子,过滤得到滤渣氢氧化铁和氢氧化铝,灼烧得到氧化铁和氧化铝,滤液电解得到锌和二氧化锰,加入碳酸钠处理剩余废液,生成的碳酸锰和碳酸锌循环使用,同时得到硫酸钠溶液浓缩蒸发、冷却结晶、过滤洗涤、干燥得到硫酸钠晶体;
,过滤得到硫单质,滤液加入物质X是调节溶液pH沉淀铁离子和铝离子,但不能引入杂质离子,过滤得到滤渣氢氧化铁和氢氧化铝,灼烧得到氧化铁和氧化铝,滤液电解得到锌和二氧化锰,加入碳酸钠处理剩余废液,生成的碳酸锰和碳酸锌循环使用,同时得到硫酸钠溶液浓缩蒸发、冷却结晶、过滤洗涤、干燥得到硫酸钠晶体;
![]() “浸取“时发生的反应中,生成
“浸取“时发生的反应中,生成![]() 、
、![]() 、
、![]() 、
、![]() ,锰元素化合价
,锰元素化合价![]() 价变化为
价变化为![]() 价被还原得到还原产物为
价被还原得到还原产物为![]() ;
;
![]() “净化除杂”时,加入的物质X是调节溶液pH沉淀铁离子和铝离子,但不能引入新的杂质;
“净化除杂”时,加入的物质X是调节溶液pH沉淀铁离子和铝离子,但不能引入新的杂质;
A.![]() ,可以调节溶液pH且不引入新的杂质,故A符合;
,可以调节溶液pH且不引入新的杂质,故A符合;
B.![]() 可以调节溶液pH且不引入新的杂质,故B符合;
可以调节溶液pH且不引入新的杂质,故B符合;
C.NaOH可以调节溶液pH但引入钠离子,故C不符合;
D.KOH可以调节溶液pH但引入钾离子,故C不符合;
故答案为:AB;
![]() “电解”时,生成锌和二氧化锰,说明是电解的硫酸锰和硫酸锌溶液,反应的化学方程式为:
“电解”时,生成锌和二氧化锰,说明是电解的硫酸锰和硫酸锌溶液,反应的化学方程式为:![]() ;
;
![]() 溶液中得到溶质固体蒸发浓缩、冷却结晶、过滤洗涤、干燥得到;
溶液中得到溶质固体蒸发浓缩、冷却结晶、过滤洗涤、干燥得到;
![]() 反应都需要在高温下进行,因此都需要消耗大量的能量;同时有
反应都需要在高温下进行,因此都需要消耗大量的能量;同时有![]() 生成会污染环境;而现在新工艺过程中,消耗的能量较小,而且不产生有毒的二氧化硫气体,有利于环保,废液循环利用,原料利用率高等,Zn和
生成会污染环境;而现在新工艺过程中,消耗的能量较小,而且不产生有毒的二氧化硫气体,有利于环保,废液循环利用,原料利用率高等,Zn和![]() 的传统生产工艺主要经历矿石焙烧、硫酸浸出、电解等过程,与传统工艺相比,该工艺流程的优点为:无二氧化硫污染性气体生成,废液可以循环利用,原料利用率高等;
的传统生产工艺主要经历矿石焙烧、硫酸浸出、电解等过程,与传统工艺相比,该工艺流程的优点为:无二氧化硫污染性气体生成,废液可以循环利用,原料利用率高等;
![]() ,
,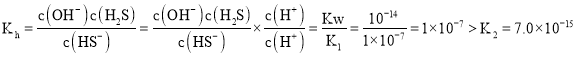 ,水解程度大,溶液显碱性,
,水解程度大,溶液显碱性,![]() ,当
,当![]() 时开始沉淀,调节溶液的
时开始沉淀,调节溶液的![]() ,
,![]() 电离常数:
电离常数:![]() ,
,![]() 浓度为
浓度为![]() 时,则
时,则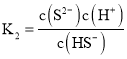 ,则
,则![]() ,则
,则![]() ,所以
,所以![]() ,解得
,解得![]() 。
。
故答案为:![]() ;5。
;5。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】溶液X中含有右表离子中的某5种,且其浓度均为![]() 不考虑水的电离与离子水解
不考虑水的电离与离子水解![]() 向X溶液加入足量稀盐酸,有无色气体生成,经分析反应前后阴离子种类没有变化.下列叙述不正确的是( )
向X溶液加入足量稀盐酸,有无色气体生成,经分析反应前后阴离子种类没有变化.下列叙述不正确的是( )
阳离子 | 阴离子 |
Fe Fe |
|
A.X溶液中不可能含有![]() 或
或![]()
B.生成无色气体的离子方程式为:![]()
C.根据电荷守恒,原溶液中一定含![]()
D.X溶液中一定含3种阳离子、2种阴离子
【题目】醋酸镍[(CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下:

T ℃时相关离子生成氢氧化物的pH和相关物质的溶解性如下表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH | 物质 | T ℃时溶解性(H2O) |
Fe3+ | 1.1 | 3.2 | CaSO4 | 微溶 |
Fe2+ | 5.8 | 8.8 | NiF2 | 可溶 |
Al3+ | 3.0 | 5.0 | CaF2 | 难溶 |
Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=1.00×10-5 |
(1)“酸浸”前将废料粉碎,其目的是____________________。
(2)调节pH步骤中,溶液pH的调节范围是________________。
(3)滤渣1主要成分的化学式是CaSO4和_____,滤渣3主要成分的化学式______。
(4)写出氧化步骤中加入H2O2发生反应的离子方程式:_______________。
(5)酸浸过程中,1 mol NiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应化学方程式:______________________。
(6)沉镍过程中,若c(Ni2+)=2.0 mol/L,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤1.0×10-5 mol/L],则需要加入Na2CO3(M=106 g/mol)固体的质量最少为_____g。
(7)加入醋酸进行酸溶得到醋酸镍溶液,一定条件指的是 ________、________过滤、洗涤、干燥得到醋酸镍产品。