题目内容
19.已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数:A<B<C<D<E.其中A、B、C是同一周期的非金属元素.化合物DC为离子化合物,D的二价阳离子与C的阴离子具有相同的电子层结构.AC2为产生温室效应的主要气体.B、C的氢化物的沸点比它们同族相邻周期元素的氢化物的沸点高.E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2:1,三个氯离子位于外界.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为C<O<N.
(2)B的氢化物分子的立体构型是三角锥形,其中心原子采取sp3杂化.
(3)写出化合物AC2的电子式:
 .
.(4)E易与多种分子形成配合物的原因是Cr原子能提供空轨道,ECl3形成的配合物的化学式为[Cr(NH3)4(H2O)2]Cl3.
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O.
分析 A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高,分子之间存在氢键,为N、O、F中的两种,A、B、C是同一周期的非金属元素,处于第二周期,AC2为产生温室效应的主要气体,该气体为二氧化碳,可推知A为碳元素、C为氧元素,B原子序数介于碳、氧之间,故B为N元素;D的二价阳离子与C的阴离子具有相同的电子层结构,C形成-2价阴离子,核外电子数为10,则D原子核外电子数为10+2=12,故D为Mg;E的原子序数为24,则E为Cr元素,CrCl3能与NH3、H2O形成六配位的配合物,且两种配体的物质的量之比为2:1,则配体中有4个NH3、2个H2O,三个氯离子位于外界,该配合物为[Cr(NH3)4(H2O)2]Cl3,据此解答.
解答 解:A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高,分子之间存在氢键,为N、O、F中的两种,A、B、C是同一周期的非金属元素,处于第二周期,AC2为产生温室效应的主要气体,该气体为二氧化碳,可推知A为碳元素、C为氧元素,B原子序数介于碳、氧之间,故B为N元素;D的二价阳离子与C的阴离子具有相同的电子层结构,C形成-2价阴离子,核外电子数为10,则D原子核外电子数为10+2=12,故D为Mg;E的原子序数为24,则E为Cr元素,CrCl3能与NH3、H2O形成六配位的配合物,且两种配体的物质的量之比为2:1,则配体中有4个NH3、2个H2O,三个氯离子位于外界,该配合物为[Cr(NH3)4(H2O)2]Cl3.
(1)同周期随原子序数增大,第一电离能呈增大趋势,N元素2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻意思是,故第一电离能由小到大的顺序为C<O<N,故答案为:C<O<N;
(2)B的氢化物为NH3,分子的立体构型是三角锥形,分子中N原子成3个σ键、含有1对孤对电子,其中心N原子采取sp3 杂化,故答案为:三角锥形;sp3;
(3)化合物CO2的电子式为 故答案为:
故答案为: ;
;
(4)Cr作为过渡金属元素,有空轨道,易与含孤对电子的分子形成配位键;CrCl3能与NH3、H2O形成六配位的配合物,且两种配体的物质的量之比为2:1,则配体中有4个NH3、2个H2O,三个氯离子位于外界,该配合物为[Cr(NH3)4(H2O)2]Cl3,
故答案为:Cr原子能提供空轨道;[Cr(NH3)4(H2O)2]Cl3;
(5)B的最高价氧化物对应的水化物为HNO3,D的单质为Mg,Mg与稀硝酸反应中硝酸被还原到最低价,则生成NH4NO3,该反应的化学方程式是:4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O,故答案为:4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O.
点评 本题考查结构性质位置关系应用,涉及电离能、分子结构、杂化轨道、电子式、配合物、氧化还原反应等,氢化物的沸点比它们同族相邻周期元素氢化物的沸点高是推断的突破口,难度中等.

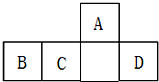 短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中B所处的周期序数与族序数相等.下列判断错误的是( )
短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中B所处的周期序数与族序数相等.下列判断错误的是( )| A. | 原子半径:B>C>A | |
| B. | 最高价氧化物对应水化物的酸性:C<D | |
| C. | 含B元素的盐溶液一定显酸性 | |
| D. | 最简单气态氢化物的热稳定性:A>C |
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3-NO3- OH- |
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,仅有B、C为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,只有A中放出无色气体,只有C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、D的化学式:BKNO3,DCuSO4.
(2)在A溶液中加入少量澄清石灰水,观察到的现象为产生白色沉淀
(3)将含lmol A的溶液与含l mol E的溶液反应后蒸干,仅得到一种化合物,该化合物化学式为Na2CO3.反应的离子方程式是HCO3-+OH-=H2O+CO32-.
(4)C常用作净水剂,用离子方程式表示其净水原理Al3++3H2O?Al(OH)3(胶体)+3H+.
| A. | 溶液呈电中性,胶体带有电荷 | |
| B. | 溶液中溶质微粒一定带电,胶体中分散质粒子带电,且通电后,溶质粒子向两极移动,胶体粒子向一极移动 | |
| C. | 溶液中溶质粒子有规律运动,而胶体粒子无规律运动 | |
| D. | 溶液中通过一束光线时无特殊现象,胶体中通过一束光时有明显的光带 |
| A. | 向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++SO42-═BaS04↓+2H2O | |
| B. | 酸性介质中KMnO4氧化 H2O2:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O | |
| C. | 等物质的量的MgCl2、Ba(OH)2 和 HCl 溶液混合:Mg2++2OH-═Mg(OH)2↓ | |
| D. | 铅酸蓄电池充电时的正极反应:PbSO4+2H2O-2e-═PbO2+4H++SO42- |
| A. | ③①②④⑤ | B. | ③①⑤②④ | C. | ③⑤②①④ | D. | ③①②⑤④ |
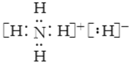 ,该物质能与水剧烈反应生成两种气体,这两种气体的化学式是H2、NH3.
,该物质能与水剧烈反应生成两种气体,这两种气体的化学式是H2、NH3. H2CO3+OH-.该盐溶液与足量稀硫酸混合,当生成11.2L(标准状况)气体(不考虑气体溶解)时放热6.32kJ,写出该反应的热化学方程式:HCO3-(aq)+H+(aq)=H2O(l)+CO2(g)△H=-12.64kJ•mol-1.
H2CO3+OH-.该盐溶液与足量稀硫酸混合,当生成11.2L(标准状况)气体(不考虑气体溶解)时放热6.32kJ,写出该反应的热化学方程式:HCO3-(aq)+H+(aq)=H2O(l)+CO2(g)△H=-12.64kJ•mol-1.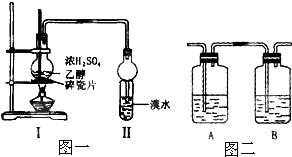 某化学兴趣小组用图一所示装置进行探究实验.以验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色.
某化学兴趣小组用图一所示装置进行探究实验.以验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色. 如图所示物质的转化关系中,A是一种固体单质,E是一种白色沉淀.请回答下列问题:
如图所示物质的转化关系中,A是一种固体单质,E是一种白色沉淀.请回答下列问题: