题目内容
8.下列离子方程式错误的是( )| A. | 向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++SO42-═BaS04↓+2H2O | |
| B. | 酸性介质中KMnO4氧化 H2O2:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O | |
| C. | 等物质的量的MgCl2、Ba(OH)2 和 HCl 溶液混合:Mg2++2OH-═Mg(OH)2↓ | |
| D. | 铅酸蓄电池充电时的正极反应:PbSO4+2H2O-2e-═PbO2+4H++SO42- |
分析 A.反应生成硫酸钡和水;
B.发生氧化还原反应,遵循电子、电荷守恒;
C.先发生酸碱中和反应;
D.充电时的正极上硫酸铅失去失去被氧化.
解答 解:A.Ba(OH)2溶液中滴加稀硫酸的离子反应为Ba2++2OH-+2H++SO42-═BaS04↓+2H2O,故A正确;
B.酸性介质中KMnO4氧化 H2O2的离子反应为2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O,遵循电子、电荷守恒,故B正确;
C.等物质的量的MgCl2、Ba(OH)2 和 HCl 溶液混合的离子反应为2H++Mg2++4OH-═Mg(OH)2↓+2H2O,故C错误;
C.铅酸蓄电池充电时的正极反应为PbSO4+2H2O-2e-═PbO2+4H++SO42-,故D正确;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应、电解的电极反应的离子反应考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.A、B、C、D、E是原子序数依次增大的短周期元素,A可以与氢组成气态氢化物分子中氢元素的质量百分含量为最高的物质,C是地壳中含量最高的金属,D与C可以形成C2D3型的化合物.
(1)C的离子结构示意图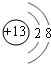 E在周期表中的位置第三周期第VIIA族
E在周期表中的位置第三周期第VIIA族
(2)A与氢元素组成的化合物分子甲中含有8个原子,与D同主族的某元素与氢组成的化合物乙与甲的电子数相等,则乙的电子式为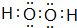
(3)B的最简单气态氢化物丙的水溶液显碱性
①在微电子工业中丙的水溶液与乙反应的产物不污染环境,其相互反应的化学方程式为2NH3•H2O+3H2O2=N2↑+8H2O
②一定条件下,丙在固定体积的密闭容器中分解(△H>0)并到达平衡,仅改变下列条件X平衡体系中随X递增Y递减的是ab
(4)C2D3能否通过复分解反应制取不能原因Al3+、S2-在水溶液中发生强烈双水解生成Al(OH)3与H2S
(5)A与D形成的液态化合物AD20.2mol在O2中完全燃烧,生成两种稳定的气态氧化物,在298K时放出热量215kJ写出表示该化合物燃烧热的热化学方程式:CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ/mol.
(1)C的离子结构示意图
 E在周期表中的位置第三周期第VIIA族
E在周期表中的位置第三周期第VIIA族(2)A与氢元素组成的化合物分子甲中含有8个原子,与D同主族的某元素与氢组成的化合物乙与甲的电子数相等,则乙的电子式为
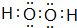
(3)B的最简单气态氢化物丙的水溶液显碱性
①在微电子工业中丙的水溶液与乙反应的产物不污染环境,其相互反应的化学方程式为2NH3•H2O+3H2O2=N2↑+8H2O
②一定条件下,丙在固定体积的密闭容器中分解(△H>0)并到达平衡,仅改变下列条件X平衡体系中随X递增Y递减的是ab
| 选项 | a | b | c | d |
| X | 温度 | 加入氢气 | 加入丙 | 温度 |
| Y | n(丙) | 丙的转化率 | n(生成物) | n(H2) |
(5)A与D形成的液态化合物AD20.2mol在O2中完全燃烧,生成两种稳定的气态氧化物,在298K时放出热量215kJ写出表示该化合物燃烧热的热化学方程式:CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ/mol.
16.用NA代表阿伏加德罗常数的值,下列有关说法正确的是( )
| A. | 78g过氧化钠晶体中,含2NA个阴离子 | |
| B. | 1L 0.1 mol/L醋酸溶液中含有的氢离子数为0.1NA | |
| C. | 在O2参与的反应中,1 mol O2作氧化剂时得到的电子数一定是4NA | |
| D. | 常温下16g O2与O3的混合气体中含氧原子数为NA |
3.下列反应的离子方程式正确的是( )
| A. | 铁片与氯化铜溶液反应:Fe+Cu2+═Cu+Fe3+ | |
| B. | 氯化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ | |
| C. | 碳酸钠溶液与盐酸反应:Na2CO3+2H+═2Na++CO2↑+H2O | |
| D. | NaHCO3溶液中加入过量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O |
13.短周期主族元素X、Y、A、B、C在元素周期表的位置如图所示,A是电负性最大的元素,则下列说法错误的是
( )
( )
| X | A | ||
| Y | C | B |
| A. | 元素原子半径大小顺序为:A<B<C<Y | |
| B. | 最高价含氧酸的酸性强弱顺序为:H2YO3<H2XO3 | |
| C. | A、B两种元素气态氢化物的沸点高低顺序为:HA<HB | |
| D. | B、C简单离子的还原性强弱顺序为:B-<C2- |
17.下列有关煤和石油的加工方法的叙述中错误的是( )
| A. | 通过煤的直接或间接液化可以获得各种芳香烃 | |
| B. | 通过石油的催化重整等工艺可获取芳香烃 | |
| C. | 石油的裂化的目的主要是为了提高轻质油的产量 | |
| D. | 石油通过常压分馏可以得到石油气、汽油、煤油、柴油等 |
18.将1.15gNa投入水中,若使每100个水分子中有一个Na+,则需水的质量为( )
| A. | 90g | B. | 90.9g | C. | 99g | D. | 9g |
 .
.