题目内容
在含有Na2CO3和Na2SO4的溶液里加入足量的BaCl2溶液,生成43g沉淀。把沉淀用足量的盐酸处理,在标准状况下放出2.24升CO2气体,则原溶液中所含Na2CO3和Na2SO4 的物质的量的比值是多少?
1:1
试题分析:解:刚开始的沉淀为BaCO3和BaSO4沉淀,加入足量的盐酸后,BaCO3溶解,设生成的BaCO3为x,即
BaCO3+2HCl=BaCl2+CO2↑+H2O
1 1
x 2.24/22.4=0.1mol
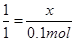 所以x=0.1mol,即BaCO3的质量n=0.1×197=19.7g,
所以x=0.1mol,即BaCO3的质量n=0.1×197=19.7g,所以BaSO4的质量为43-19.7=23.3,
即Na2SO4的物质的量n=23.3/233=0.1mol,
Na2CO3的物质的量n=0.1mol,
所以Na2CO3和Na2SO4 的物质的量的比值=0.1:0.1=1:1
点评:本题考查了利用化学方程式的简单计算,物质的量的计算,本题难度不大。

练习册系列答案
相关题目