题目内容
9.75g锌与 mol的盐酸刚好完全反应,放出 mol H2,在溶液中有
mol Zn2+ 和 mol Cl-,把反应后的溶液蒸干,可以得到ZnCl2 mol。
mol Zn2+ 和 mol Cl-,把反应后的溶液蒸干,可以得到ZnCl2 mol。
0.3, 0.15 , 0.15, 0.3 ,0.15
试题分析: 根据Zn+2HCl=ZnCl2+H2↑可以知道盐酸的物质的量n=2×9.75/65=0.3mol,放出氢气的物质的量n=9.75/65=0.15mol,溶液中有0.15mol Zn2+ 和0.3mol Cl-,把反应后的溶液蒸干,可以得到ZnCl2为0.15mol。
点评:本题考查了物质的量,化学基本计算,本题难度不大,但是本题有一个不妥之处是,最后一个空,考虑到学生是刚刚接触高中化学,还没有学习盐类的水解,所以答案才为0.15mol,若考虑水解,则得到的ZnCl2 为0mol。

练习册系列答案
相关题目

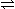 2NO2
2NO2