题目内容
下列实验中,不能达到目的的是
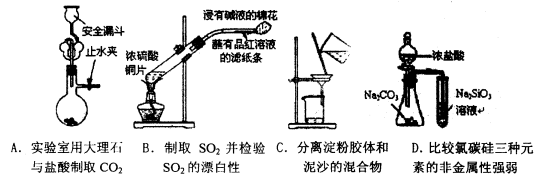

D
试题分析:A、大理石的主要成分是碳酸钙,与盐酸反应生成CO2,且用安全漏斗,装置符合要求,因此可以达到实验目的,A不符合题意;浓硫酸与铜反应生成SO2,SO2具有漂白性可以使品红溶液褪色。又因为SO2还是大气污染物,需要尾气处理,因此装置可以达到实验目的,B不符合题意;C、胶体可以透过滤纸,因此分离淀粉胶体与泥沙的混合物可以用过滤的方法,可以达到实验目的,C不符合题意;D、要比较氯、碳、硅三种元素的非金属性强弱,应该用高氯酸,即应该用最高价氧化物水化物,所以达不到实验目的,D符合题意,答案选D。

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
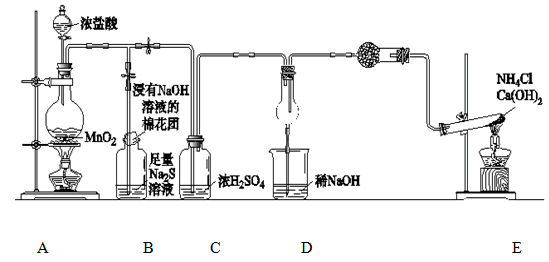
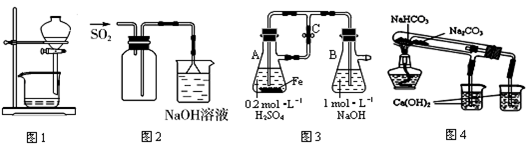
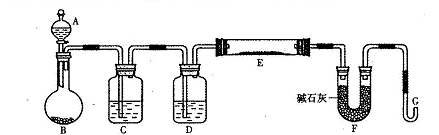
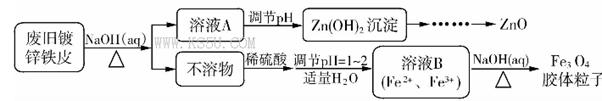
 Fe3O4(胶体)+S4O62-+H2O
Fe3O4(胶体)+S4O62-+H2O

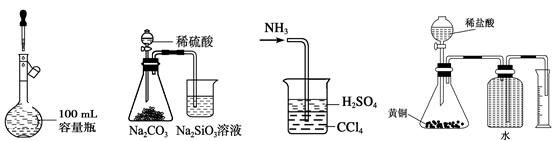
 A.定容
A.定容