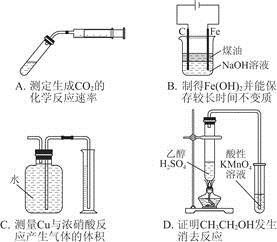
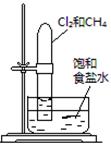
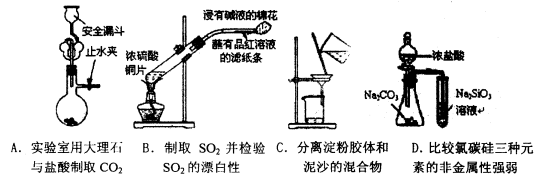
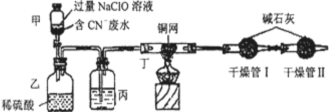
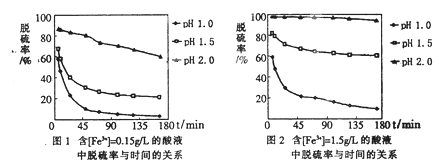
题目内容
白铁皮(镀锌铁皮)常用于制造屋面、卷管和各种容器,利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程如下:
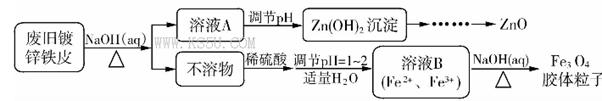
已知:Zn及其化合物的性质与Al及其化合物的性质相似。请回答下列问题:
(1)用NaOH溶液处理废旧镀锌铁皮的作用是____________。
a.去除油污 b.溶解镀锌层 c.去除铁锈 d.钝化
(2)为获得Fe3O4胶体粒子,溶液B中必须含有一定量的Fe2+,可利用________检验其是否存在。
a.NaOH溶液 b.KSCN溶液 c.溶液KMnO4 d.氯水
(3)由溶液B制备Fe3O4胶体粒子的过程中,必须持续通入N2以保证产品的纯度,其原因是_____________ .
(4)在工业上常用水热法制造Fe3O4胶体粒子,有利于提高其纯度和磁性能,主要反应过程为:Fe2++S2O32-+O2+OH- Fe3O4(胶体)+S4O62-+H2O
Fe3O4(胶体)+S4O62-+H2O
①反应过程中起还原剂作用的微粒是________________;
②若反应过程中产生的Fe3O4(胶体)与S4O62-均为1mol,则参加反应的氧气在标准状况下的体积为____________L。

已知:Zn及其化合物的性质与Al及其化合物的性质相似。请回答下列问题:
(1)用NaOH溶液处理废旧镀锌铁皮的作用是____________。
a.去除油污 b.溶解镀锌层 c.去除铁锈 d.钝化
(2)为获得Fe3O4胶体粒子,溶液B中必须含有一定量的Fe2+,可利用________检验其是否存在。
a.NaOH溶液 b.KSCN溶液 c.溶液KMnO4 d.氯水
(3)由溶液B制备Fe3O4胶体粒子的过程中,必须持续通入N2以保证产品的纯度,其原因是_____________ .
(4)在工业上常用水热法制造Fe3O4胶体粒子,有利于提高其纯度和磁性能,主要反应过程为:Fe2++S2O32-+O2+OH-
 Fe3O4(胶体)+S4O62-+H2O
Fe3O4(胶体)+S4O62-+H2O①反应过程中起还原剂作用的微粒是________________;
②若反应过程中产生的Fe3O4(胶体)与S4O62-均为1mol,则参加反应的氧气在标准状况下的体积为____________L。
(1)ab (2)c (3)N2气氛下,防止Fe2+被氧化 (4)①Fe2+、S2O32- ②22.4
试题分析:(1)根据信息“Zn及化合物的性质与Al及化合物的性质相似”知,Zn也能和氢氧化钠溶液反应,氢氧化钠溶液起到溶解镀锌层和去除油污作用,选ab;
(2)溶液B中含有Fe3+和Fe2+,要检验其中的Fe2+要利用其还原性,能使溶液KMnO4溶液褪色,选c;
(3)Fe2+具有较强的还原性,易被氧化,持续通入N2,防止Fe2+被氧化;
(4)①反应过程中铁元素的化合价由Fe2+中的+2价升高到Fe3O4中的+3价,硫元素的化合价由S2O32-中的+2价升高到S4O62-中的+2.5价,Fe2+和S2O32-被氧化作还原剂;②反应过程中铁元素的化合价由Fe2+中的+2价升高到Fe3O4中的+3价,硫元素的化合价由S2O32-中的+2价升高到S4O62-中的+2.5价,产生的Fe3O4(胶体)与S4O62-均为1mol,失去的电子共4 mol,根据得失电子守恒知,参加反应的O2为1mol,标准状况下的体积为22.4L。3O4胶体粒子及副产物ZnO”为载体,考查化学实验基本操作,涉及溶液配制仪器的选择、Fe2+的检验及氧化还原反应相关知识。

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目