题目内容
某研究性学习小组利用H2还原法测定两种铜的氧化物CuO、Cu2O混合粉末中铜元素的质量分数。下图是测定装置的示意图,A中的试剂是盐酸。

请回答下列问题。
(1)烧瓶中装入的试剂是锌粒,其中将发生反应的离子方程式是 ;
(2)试剂C是水,其作用是__ __;
(3)试剂D是__ __,其作用是干燥氢气;
(4)连接好装置后的实验操作依次是_ __(填下列操作序号)
①检验氢气纯度;②加热E;③检验装置气密性;④点燃G管溢出的气体;⑤从A瓶逐滴滴加液体
(5)已知:C(s)+1/2O2( g)= CO(g) △H=-110.5kJ·mol-1,
Cu2O(s) +1/2O2(g) = 2CuO(s) △H=-145 kJ·mol-1
则用炭粉在高温条件下还原CuO生成Cu2O的热化学方程式:____ 。

请回答下列问题。
(1)烧瓶中装入的试剂是锌粒,其中将发生反应的离子方程式是 ;
(2)试剂C是水,其作用是__ __;
(3)试剂D是__ __,其作用是干燥氢气;
(4)连接好装置后的实验操作依次是_ __(填下列操作序号)
①检验氢气纯度;②加热E;③检验装置气密性;④点燃G管溢出的气体;⑤从A瓶逐滴滴加液体
(5)已知:C(s)+1/2O2( g)= CO(g) △H=-110.5kJ·mol-1,
Cu2O(s) +1/2O2(g) = 2CuO(s) △H=-145 kJ·mol-1
则用炭粉在高温条件下还原CuO生成Cu2O的热化学方程式:____ 。
(1)Zn + 2H+= Zn2+ + H2↑ (1分)
(2)吸收氢气中的HCl气体(1分)
(3)浓硫酸(1分)
(4)③⑤①④②(2分)
(5)2CuO(s)+C(s) = Cu2O(s)+CO(g) ΔH="34.5" kJ·mol-1。(2分)
(2)吸收氢气中的HCl气体(1分)
(3)浓硫酸(1分)
(4)③⑤①④②(2分)
(5)2CuO(s)+C(s) = Cu2O(s)+CO(g) ΔH="34.5" kJ·mol-1。(2分)
试题分析:A、B装置是氢气的发生装置,C装置是除杂装置,目的是除去氢气中的HCl气体,D装置是干燥装置,E是反应装置,碱石灰是吸收生成的水,G
(4)收集或进行气体实验时,应在装入药品前先进行气密性的检查。点燃可燃性气体(如H2、CO、CH4、C2H2、C2H4等)之前,或用CO、H2还原Fe2O3、CuO之前,要检验气体纯度,能点燃G管溢出的气体,说明氢气充满了整个装置,然后再加热E,不会发生危险。
(5)热化学方程式的合并。由第一个方程式减去第二个方程式即可得到目标方程式。

练习册系列答案
相关题目
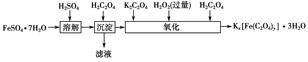
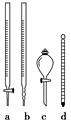
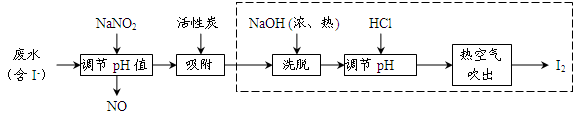
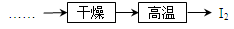


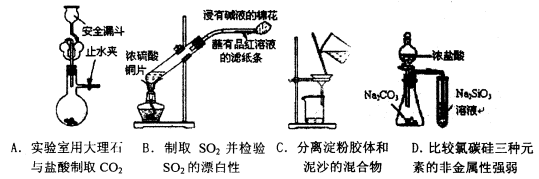
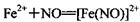 (棕色)。已知,同浓度的硝酸氧化性比Fe3+略强。
(棕色)。已知,同浓度的硝酸氧化性比Fe3+略强。