题目内容
4.绿原酸的结构简式如图,下列关于绿原酸的说法不正确的是( )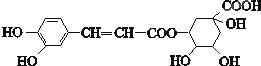
| A. | 分子式为C16H18O9 | |
| B. | 0.1mol绿原酸最多与含0.4molNaOH溶液反应 | |
| C. | 能发生取代、还原、氧化和消去反应 | |
| D. | 0.1mol绿原酸最多与含0.6molBr2的浓溴水反应 |
分析 由结构简式可知,分子中含酚-OH、-COOH、碳碳双键、醇-OH、-COOC-,结合醇、酚、烯烃、酯的性质来解答.
解答 解:A.由结构简式可知,分子式为C16H18O9,故A正确;
B.含2个酚-OH、1个-COOH、1个-COOC-,均可与NaOH溶液反应,0.1mol绿原酸最多与含0.4molNaOH溶液反应,故B正确;
C.由结构简式可知,含羟基可发生取代、氧化反应,醇-OH可发生消去反应,碳碳双键可发生还原反应,故C正确;
D.含碳碳双键,能使溴发生加成反应,酚-OH的邻对位与溴水发生取代反应,则0.1mol绿原酸最多与含0.4molBr2的浓溴水反应,故D错误;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重酚、醇、烯烃性质的考查,注意酚与醇的差别,题目难度不大.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
8.用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 在标准状况下,2.24L苯中含有0.6NA个碳原子 | |
| B. | 1L pH=1的硫酸溶液中含有0.2NA个氢离子 | |
| C. | 1L 1mol•L-1的FeCl3溶液中,含有铁离子的数目为NA | |
| D. | t时,1L pH=6的纯水中,含有10-6NA个OH- |
12.氯、溴、碘等卤族元素主要来自海水,很多海洋植物中都含有大量的碘,
反应①是从海藻灰中提取碘的主要反应,反应②是从智利硝石中提取碘的主要反应:
2NaI+MnO2+3H2SO4═2NaHSO4+MnSO4+2H2O+I2①
2NaIO3+5NaHSO3═2Na2SO4+3NaHSO4+H2O+I2②
下列有关说法正确的是( )
反应①是从海藻灰中提取碘的主要反应,反应②是从智利硝石中提取碘的主要反应:
2NaI+MnO2+3H2SO4═2NaHSO4+MnSO4+2H2O+I2①
2NaIO3+5NaHSO3═2Na2SO4+3NaHSO4+H2O+I2②
下列有关说法正确的是( )
| A. | NaI和NaIO3在一定条件下能反应生成I2 | |
| B. | I2在反应①中是还原产物,在反应②中是氧化产物 | |
| C. | 两个反应中生成等量的I2时转移电子数相等 | |
| D. | 氧化性:MnO2>IO3->SO42->Mn42+ |
9.除去下列物质中所含杂质(括号中的物质)所选用的试剂和装置均正确的是( )
Ⅰ.试剂:①KMnO4/H+②NaOH溶液 ③饱和Na2CO3溶液④H2O ⑤Na ⑥Br2/H2O ⑦Br2/CCl4
Ⅱ.装置:
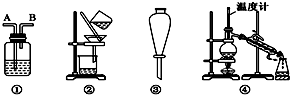
Ⅰ.试剂:①KMnO4/H+②NaOH溶液 ③饱和Na2CO3溶液④H2O ⑤Na ⑥Br2/H2O ⑦Br2/CCl4
Ⅱ.装置:

| 选项 | 物质 | 试剂 | 装置 |
| A | C2H6(C2H4) | ⑥ | ① |
| B | 苯(苯酚) | ① | ③ |
| C | CH3COOC2H5(CH3COOH) | ③ | ② |
| D | 甲苯(二甲苯) | ① | ③ |
| A. | A | B. | B | C. | C | D. | D |
 连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体
连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体