题目内容
6.下列说法正确的是( )| A. | 气体摩尔体积为22.4L/mol | B. | 1molNaOH的质量为40g | ||
| C. | 0.5molCO2的体积为11.2L | D. | H2O的摩尔质量为18g |
分析 A、气体摩尔体积的数值和状态有关;
B、根据质量m=nM来计算;
C、气体的体积V=nVm;
D、摩尔质量的单位为g/mol.
解答 解:A、气体摩尔体积的数值和状态有关,状态不确定,故气体摩尔体积的数值不确定,不一定是22.4L/mol,故A错误;
B、1mol氢氧化钠的质量m=nM=1mol×40g/mol=40g,故B正确;
C、气体的体积V=nVm,与气体所处的状态有关,故0.5mol气体的体积不一定是11.2L,故C错误;
D、摩尔质量的单位为g/mol,故水的摩尔质量为18g/mol,故D错误.
故选B.
点评 本题考查了气体摩尔体积的取值和摩尔质量的单位等问题,应注意的是气体摩尔体积的数值有无数个,在标况下,为22.4L/mol.

练习册系列答案
相关题目
16.下列物质的命名正确的是( )
| A. | 3,3-二甲基丁烷 | B. | 2,2-二甲基-2-乙基乙烷 | ||
| C. | 2,3-二甲基-4-乙基己烷 | D. | 2,5,5-三甲基己烷 |
17.用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图象如下:
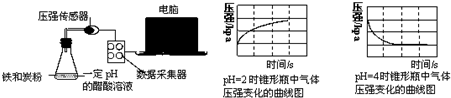
分析图象,以下结论错误的是( )

分析图象,以下结论错误的是( )
| A. | 析氢腐蚀和吸氧腐蚀的速率一样快 | |
| B. | 在酸性溶液中生铁可能发生吸氧腐蚀 | |
| C. | 溶液pH≤2时,生铁发生析氢腐蚀 | |
| D. | 两溶液中负极反应均为:Fe-2e-═Fe2+ |
14.油脂水解的最终产物是( )
| A. | 酸和甘油 | B. | 水 | C. | CO2 | D. | 水和CO2 |
1.酸雨的形成主要是由于( )
| A. | 森林遇到乱砍乱伐,破坏了生态平衡 | |
| B. | 燃放烟花爆竹 | |
| C. | 大气中二氧化碳的含量增加 | |
| D. | 工业上大量燃烧含硫燃料 |
11.灰锡(以粉末状存在)和白锡(韧性很好)是锡的两种同素异形体.已知:
①Sn(s、白)+2HCl(aq)=SnCl2(aq)+H2(g)△H1
②Sn(s、灰)+2HCl(aq)=SnCl2(aq)+H2(g)△H2
③Sn(s、灰)$?_{<13.2℃}^{>13.2℃}$Sn(s、白)△H3=+2.1kJ•mol-1
下列说法正确的是( )
①Sn(s、白)+2HCl(aq)=SnCl2(aq)+H2(g)△H1
②Sn(s、灰)+2HCl(aq)=SnCl2(aq)+H2(g)△H2
③Sn(s、灰)$?_{<13.2℃}^{>13.2℃}$Sn(s、白)△H3=+2.1kJ•mol-1
下列说法正确的是( )
| A. | △H1>△H2 | |
| B. | 锡的两种同素异形体在常温下可以相互转化,是可逆反应 | |
| C. | 灰锡转化为白锡的反应是吸热反应 | |
| D. | 锡制器皿应置于高于13.2℃的环境中,否则会自行毁坏 |
18.C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3KJ/mol.它表示( )
| A. | 碳与水反应吸收131.3 KJ的热量 | |
| B. | 固态碳和气态水各1mol反应,放出131.3 KJ的热量 | |
| C. | 1mol碳和1mol水反应吸收131.3 KJ的热量 | |
| D. | 1mol固态焦炭与1mol水蒸气反应产生一氧化碳和氢气,吸收131.3 KJ的热量 |
15.下列说法错误的是( )
| A. | 烧碱是强电解质,在水溶液中完全电离,不存在电离平衡 | |
| B. | 将水加热,水的电离平衡向正反应方向移动,Kw变大 | |
| C. | 向溶液中加酸、加碱都能抑制水的电离 | |
| D. | 根据溶液导电能力强弱,将电解质分为强电解质、弱电解质 |