题目内容
18.C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3KJ/mol.它表示( )| A. | 碳与水反应吸收131.3 KJ的热量 | |
| B. | 固态碳和气态水各1mol反应,放出131.3 KJ的热量 | |
| C. | 1mol碳和1mol水反应吸收131.3 KJ的热量 | |
| D. | 1mol固态焦炭与1mol水蒸气反应产生一氧化碳和氢气,吸收131.3 KJ的热量 |
分析 C(s)+H2O(g)═CO(g)+H2(g);△H=+131.3KJ/mol表示1mol固体碳与1mol水蒸气完全反应生成1mol一氧化碳气体和1mol氢气,吸收热量131.3KJ,反应热与反应物生成物聚集状态有关,表述时应说明聚集状态,据此解答.
解答 解:A.在表述热化学方程式时,应表述出物质的状态,故A错误;
B.该反应为吸热反应,故B错误;
C.物质的聚集状态影响到物质所具有的能量,在表述热化学方程式时,应表述出物质的状态,故C错误;
D.由热化学方程式可知,1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ,故D正确;
故选:D.
点评 本题考查热化学方程式知识,明确热化学方程式的含义是解题关键,注意物质的聚集状态影响到物质所具有的能量,在表述热化学方程式时,应表述出物质的状态,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.在一定温度下的定容密闭容器中,当下列物理量不再变化时,表明反应:A(s)+2B(g)?C(g)+D(g) 已达平衡的是( )
| A. | 混合气体的压强 | B. | 混合物的总质量 | ||
| C. | B的物质的量浓度 | D. | 气体的总物质的量 |
6.下列说法正确的是( )
| A. | 气体摩尔体积为22.4L/mol | B. | 1molNaOH的质量为40g | ||
| C. | 0.5molCO2的体积为11.2L | D. | H2O的摩尔质量为18g |
13.下列离子反应方程式,书写正确的是( )
| A. | Na2CO3溶液中加入盐酸:CO32-+2H+═CO2↑+H2O | |
| B. | 稀硫酸中加入铁粉:2Fe+6H+═2Fe3++3H2↑ | |
| C. | CaCO3中加入盐酸:CO32-+2H+═H2O+CO2↑ | |
| D. | Ba(OH)2溶液中加入硫酸:H++OH-═H2O |
3.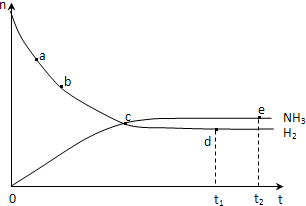 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点a的正反应速率比点b的小 | |
| B. | 点 c处反应达到平衡 | |
| C. | 点d (t1时刻) 和点 e (t2时刻) 处n(N2)不一样 | |
| D. | 其他条件不变,773K下反应至t1时刻,n(H2)比上图中d点的值大 |
10.为了确定碳酸氢钠固体中是否含有碳酸钠.下列实验操作及判断中正确的是( )
| A. | 观察加热时能否放出气体 | |
| B. | 观察加盐酸时能否放出气体 | |
| C. | 溶于水中,加入澄清石灰水,观察是否有白色沉淀生成 | |
| D. | 溶于水中,滴加少量BaCl2溶液,观察是否有白色沉淀生成 |