题目内容
15.下列说法错误的是( )| A. | 烧碱是强电解质,在水溶液中完全电离,不存在电离平衡 | |
| B. | 将水加热,水的电离平衡向正反应方向移动,Kw变大 | |
| C. | 向溶液中加酸、加碱都能抑制水的电离 | |
| D. | 根据溶液导电能力强弱,将电解质分为强电解质、弱电解质 |
分析 强电解质:在水溶液中或熔融状态下能完全电离的化合物;弱电解质:在水溶液中或熔融状态下不能完全电离的化合物.
解答 解:A、烧碱是氢氧化钠,属于强碱,是强电解质,在水中完全电离,不存在电离平衡,故A正确;
B、水的电离为吸热过程,升高温度,平衡右移,水的离子积增大,故B正确;
C、水电离出氢离子和氢氧根离子,加酸和碱均抑制水的电离,故C正确;
D、依据电解质在水中是否完全电离,把电解质分为强电解质和弱电解质,电解质强弱与导电能力无关,故D错误,
故选D.
点评 本题考查了强电解质的判断,难度不大,注意电解质的强弱与导电能力以及溶解性大小无关,与电离程度有关.

练习册系列答案
相关题目
5.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是( )
| A. | 放电时正极反应式为:3Zn-6e-+6OH-═3Zn(OH)2 | |
| B. | 充电时阳极反应式为:2FeO42-+6e-+8H2O═2Fe(OH)3+10OH- | |
| C. | 放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化 | |
| D. | 放电时正极附近溶液的碱性增强 |
6.下列说法正确的是( )
| A. | 气体摩尔体积为22.4L/mol | B. | 1molNaOH的质量为40g | ||
| C. | 0.5molCO2的体积为11.2L | D. | H2O的摩尔质量为18g |
3.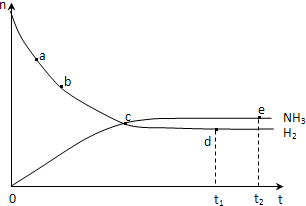 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g)△H<0,673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点a的正反应速率比点b的小 | |
| B. | 点 c处反应达到平衡 | |
| C. | 点d (t1时刻) 和点 e (t2时刻) 处n(N2)不一样 | |
| D. | 其他条件不变,773K下反应至t1时刻,n(H2)比上图中d点的值大 |
10.为了确定碳酸氢钠固体中是否含有碳酸钠.下列实验操作及判断中正确的是( )
| A. | 观察加热时能否放出气体 | |
| B. | 观察加盐酸时能否放出气体 | |
| C. | 溶于水中,加入澄清石灰水,观察是否有白色沉淀生成 | |
| D. | 溶于水中,滴加少量BaCl2溶液,观察是否有白色沉淀生成 |
2.某有机物的结构为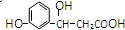 ,它不可以发生的反应类型有:①加成;②水解;③消去;④酯化;⑤银镜;⑥氧化;⑦取代;⑧加聚;⑨缩聚.( )
,它不可以发生的反应类型有:①加成;②水解;③消去;④酯化;⑤银镜;⑥氧化;⑦取代;⑧加聚;⑨缩聚.( )
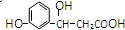 ,它不可以发生的反应类型有:①加成;②水解;③消去;④酯化;⑤银镜;⑥氧化;⑦取代;⑧加聚;⑨缩聚.( )
,它不可以发生的反应类型有:①加成;②水解;③消去;④酯化;⑤银镜;⑥氧化;⑦取代;⑧加聚;⑨缩聚.( )| A. | ①⑤⑧ | B. | ①②⑤⑨ | C. | ②⑥⑧⑨ | D. | ②⑤⑧ |