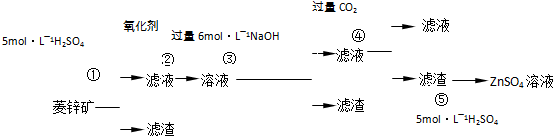
题目内容
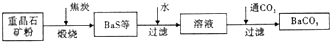
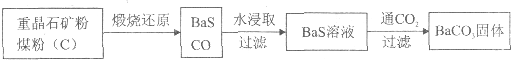
重晶石(BaSO4)难溶于水,要转化成BaCO3再制备其他钡盐。工业上一般采用高温煅烧还原法;实验室可以采用沉淀转化法。
●高温煅烧还原法

(1)煅烧还原的热化学方程式为:
有关的数据:Ba(s)+S(s)+2O2(g)=BaSO4(s); △H= -1473.2 kJ?mol-1
C(s)+ ![]() O2(g)=CO(g); △H= -110.5 kJ?mol-1
O2(g)=CO(g); △H= -110.5 kJ?mol-1
Ba(s)+S(s)=BaS(s); △H= -460kJ?mol-1
(2)经检验BaS的水溶液呈碱性,原因是(用离子方程式表示)
●沉淀转化法
向BaSO4沉淀中加入饱和Na2CO3溶液,充分搅拌,弃去上层清液。如此处理多次,直到BaSO4全部转化为BaCO3:BaSO4(s)+CO32(aq)![]() BaCO3(s)+SO42(aq)(平衡常数K=0.042)
BaCO3(s)+SO42(aq)(平衡常数K=0.042)
(3)现有0.20 mol BaSO4,每次用1.00 L 2.0mol?L-1饱和Na2CO3溶液处理,假定BaSO4能全部转化,至少需要处理多少次?(写出计算过程)
(4)从“绿色化学”角度分析,用饱和Na2CO3溶液沉淀转化法的优点是
(1)BaSO4(s)+4C(s)= BaS(s)+4CO(g);△H= +571.2 kJ•mol―1
(2)S2― + H2O ![]() HS- + OH-
HS- + OH-
(3)计算过程 :设每次用1.00L 2.0 mol•L-1饱和Na2CO3溶液能处理xmol BaSO4
BaSO4 + CO32― = BaCO3 + SO42―
(2.0―x) mol•L-1 x mol•L-1
K=![]() = 0.042;
= 0.042;
X = 0.081;
处理次数 = 0.2mol/0.081mol=2.5。
答:至少处理3次
(4)节能,环保

 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案