题目内容
(2010?启东市模拟)锌钡白是一种白色颜料.工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4=ZnS↓+BaSO4↓.以下是工业生产流程.请回答有关问题:
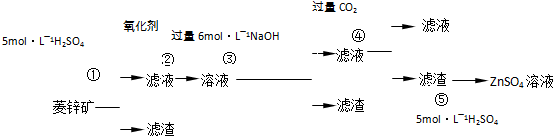
Ⅰ.ZnSO4溶液的制备与提纯有关资料:已知Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2;菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等.
(1)②中使用的氧化剂最好是下列的
A.Cl2 B.H2O2 C.KMnO4 D.浓HNO3
(2)写出反应④的离子方程式:
(3)为了达到综合利用、节能减排的目的,上述流程中步骤
Ⅱ.BaS溶液的制备
有关数据:Ba(s)+S(s)+2O2(g)=BaSO4(s);△H=-1473.2kJ?mol-1
C(s)+-O2(g)=CO(g);△H=-110.5kJ?mol-1
Ba(s)+S(s)=BaS(s);△H=-460kJ?mol-1
重晶石(BaSo4)矿粉、煤粉
BaS+CO↑
BaS溶液
(4)煅烧还原的热化学方程式为:
(5)经检验BaS的水溶液呈碱性,原因是(用离子方程式表示)
Ⅲ.制取锌钡白
(6)Ⅰ中步骤⑤使用硫酸的量要适当,如果所得溶液的酸性过强,产生的后果是

Ⅰ.ZnSO4溶液的制备与提纯有关资料:已知Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2;菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等.
(1)②中使用的氧化剂最好是下列的
B
B
(填序号),理由是不会引入杂质
不会引入杂质
.A.Cl2 B.H2O2 C.KMnO4 D.浓HNO3
(2)写出反应④的离子方程式:
ZnO22-+2CO2+2H2O=Zn(OH)2↓+2HCO3-
ZnO22-+2CO2+2H2O=Zn(OH)2↓+2HCO3-
.(3)为了达到综合利用、节能减排的目的,上述流程中步骤
①
①
产生的CO2
CO2
可以用于步骤④
④
(其中步骤选填①、②、③、④、⑤).Ⅱ.BaS溶液的制备
有关数据:Ba(s)+S(s)+2O2(g)=BaSO4(s);△H=-1473.2kJ?mol-1
C(s)+-O2(g)=CO(g);△H=-110.5kJ?mol-1
Ba(s)+S(s)=BaS(s);△H=-460kJ?mol-1
重晶石(BaSo4)矿粉、煤粉
| 煅烧还原 |
| 水浸取 |
| 过滤 |
(4)煅烧还原的热化学方程式为:
BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2 kJ?mol-1
BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2 kJ?mol-1
.(5)经检验BaS的水溶液呈碱性,原因是(用离子方程式表示)
S2-+H2O?HS-+OH-
S2-+H2O?HS-+OH-
.Ⅲ.制取锌钡白
(6)Ⅰ中步骤⑤使用硫酸的量要适当,如果所得溶液的酸性过强,产生的后果是
酸性过强,与BaS溶液混合是可能产生H2S气体污染,锌钡白的产率会降低
酸性过强,与BaS溶液混合是可能产生H2S气体污染,锌钡白的产率会降低
.分析:(1)依据反应后的产物和实验目的分析,氧化剂是隐含亚铁离子,选择氧化剂不能引入新的杂质;
(2)依据流程图分析反应为和产物,结合反应原理书写离子方程式;
(3)循环利用节能减排,步骤①产生的二氧化碳通入步骤④中可以循环利用;
(4)依据热化学方程式和盖斯定律计算得到;
(5)硫化钡水溶液中水解显碱性;
(6)硫酸过量会生成有毒气体硫化氢污染环境,减少锌钡白的产量.
(2)依据流程图分析反应为和产物,结合反应原理书写离子方程式;
(3)循环利用节能减排,步骤①产生的二氧化碳通入步骤④中可以循环利用;
(4)依据热化学方程式和盖斯定律计算得到;
(5)硫化钡水溶液中水解显碱性;
(6)硫酸过量会生成有毒气体硫化氢污染环境,减少锌钡白的产量.
解答:解:(1)ZnCO3,FeCO3、Cu2(OH)2CO3都能溶液足量5mol/L硫酸溶液中,生成ZnSO4,FeSO4,CuSO4,CO2,H2O;SiO2不溶于硫酸,步骤①得到滤渣为SiO2;滤液为ZnSO4,FeSO4,CuSO4,H2O;步骤②用氧化剂是氧化亚铁离子;
A、氯气做氧化剂氧化亚铁离子会引入氯离子,且氯气有毒,故A不选;
B、过氧化氢做氧化剂被还原为水,不引入新的杂质,过量的过氧化氢加热胡分解生成氧气和水,故B正确;
C、KMnO4 做氧化剂会引入K+,MnO4-,故C错误;
D、浓HNO3做氧化剂会被还原为有毒气体NO2,引入杂质离子NO3-,故D错误;
故答案为:B;不会引入新的杂质离子;
(2)偏铝酸钠溶液中通入二氧化碳气体会生成氢氧化铝沉淀,由此推断步骤④发生的反应是Na2ZnO2,NaOH和二氧化碳反应滤渣为Zn(OH)2,滤液为NaHCO3,反应的离子方程式为:ZnO22-+2CO2+2H2O=Zn(OH)2↓+2HCO3-,故答案为:ZnO22-+2CO2+2H2O=Zn(OH)2↓+2HCO3-;
(3)步骤④中的CO2气体来自步骤①酸浸反应放出的气体,可以节能减排,故答案为:①;CO2;④;
(4)①Ba(s)+S(s)+2O2(g)=BaSO4(s);△H=-1473.2kJ?mol-1
②C(s)+
O2(g)=CO(g);△H=-110.5kJ?mol-1
③Ba(s)+S(s)=BaS(s);△H=-460kJ?mol-1
依据盖斯定律②×4-③-①得到热化学方程式为:BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2 kJ?mol-1,
故答案为:BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2 kJ?mol-1;
(5)经检验BaS的水溶液呈碱性说明硫离子水解的原因,反应的离子方程式为S2-+H2O?HS-+OH-,故答案为:S2-+H2O?HS-+OH-;
(6)若步骤⑤为氢氧化锌和改过了硫酸反应,所得溶液中含有硫酸锌和硫酸,与BaS反应可以制的锌钡白,同时过量硫酸和BaS反应生成有毒气体H2S污染空气,减少锌钡白的产量,
故答案为:酸性过强,与BaS溶液混合是可能产生H2S气体污染,或锌钡白的产率会降低.
A、氯气做氧化剂氧化亚铁离子会引入氯离子,且氯气有毒,故A不选;
B、过氧化氢做氧化剂被还原为水,不引入新的杂质,过量的过氧化氢加热胡分解生成氧气和水,故B正确;
C、KMnO4 做氧化剂会引入K+,MnO4-,故C错误;
D、浓HNO3做氧化剂会被还原为有毒气体NO2,引入杂质离子NO3-,故D错误;
故答案为:B;不会引入新的杂质离子;
(2)偏铝酸钠溶液中通入二氧化碳气体会生成氢氧化铝沉淀,由此推断步骤④发生的反应是Na2ZnO2,NaOH和二氧化碳反应滤渣为Zn(OH)2,滤液为NaHCO3,反应的离子方程式为:ZnO22-+2CO2+2H2O=Zn(OH)2↓+2HCO3-,故答案为:ZnO22-+2CO2+2H2O=Zn(OH)2↓+2HCO3-;
(3)步骤④中的CO2气体来自步骤①酸浸反应放出的气体,可以节能减排,故答案为:①;CO2;④;
(4)①Ba(s)+S(s)+2O2(g)=BaSO4(s);△H=-1473.2kJ?mol-1
②C(s)+
| 1 |
| 2 |
③Ba(s)+S(s)=BaS(s);△H=-460kJ?mol-1
依据盖斯定律②×4-③-①得到热化学方程式为:BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2 kJ?mol-1,
故答案为:BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2 kJ?mol-1;
(5)经检验BaS的水溶液呈碱性说明硫离子水解的原因,反应的离子方程式为S2-+H2O?HS-+OH-,故答案为:S2-+H2O?HS-+OH-;
(6)若步骤⑤为氢氧化锌和改过了硫酸反应,所得溶液中含有硫酸锌和硫酸,与BaS反应可以制的锌钡白,同时过量硫酸和BaS反应生成有毒气体H2S污染空气,减少锌钡白的产量,
故答案为:酸性过强,与BaS溶液混合是可能产生H2S气体污染,或锌钡白的产率会降低.
点评:本题考查了物质制备流程分析判断,环节中所得物质成分分析,除杂试剂选择,循环利用的物质推断,离子方程式、热化学方程式书写,实验方案的评价,题目难度中等.

练习册系列答案
相关题目
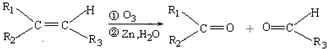 (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)
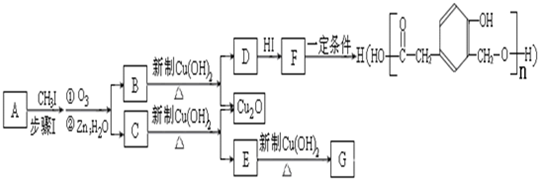
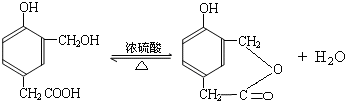
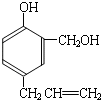


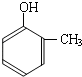 到的合成
到的合成 路线(用合成路线流程图表示,并注明反应条件).
路线(用合成路线流程图表示,并注明反应条件).

 (2010?启东市模拟)直接NaBH4/H2O2燃料电池(DBFC)的结构如图,“负极材料采用Pt/C,正极材料采用MnO2”,有关该电池的说法正确的是
(2010?启东市模拟)直接NaBH4/H2O2燃料电池(DBFC)的结构如图,“负极材料采用Pt/C,正极材料采用MnO2”,有关该电池的说法正确的是