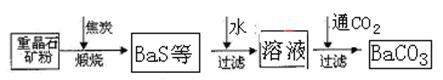
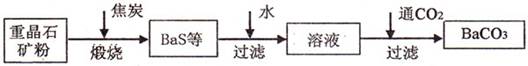
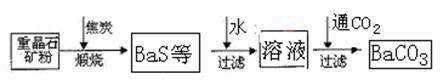
题目内容

已知:BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2kJ?mol-1
Ba(s)+S(s)+2O2(g):BaSO4(s)△H=-1473.2kJ?mol-1
Ba(s)+S(s)=BaS(g)△H=-460kJ?mol-1
请回答:
(1)工业上煅烧重晶石矿粉时,为使BaSO4得到充分还原和维持反应所需的高温,应采取的措施是
(2)沉淀转化法制备BaCO3可用饱和Na2CO3溶液将BaSO4转化为BaCO3:
BaSO4(s)+CO2-3(aq)=BaCO3(s)+SO2-4(aq)
则:在实验室中将少量BaSO4沉淀全部转化为BaCO3的实验操作方法与步骤为
(3)与高温煅烧还原法相比,用饱和Na2CO3溶液沉淀转化法的优点主要有
(2)依据碳酸钡溶度积,需要增加碳酸根离子使碳酸根离子浓度和钡离子浓度乘积大于溶度积形成碳酸钡沉淀;
(3)与高温煅烧还原法相比,(用饱和Na2CO3溶液的)沉淀转化法的优点是节能环保;
故答案为:加入过量的炭,同时通入空气;
(2)在实验室将少量BaSO4沉淀全部转化为BaCO3的实验操作方法是将适量饱和Na2CO3溶液加入BaSO4沉淀中,充分搅拌,静置、弃去上层清液,如此操作,反复多次直到BaSO4全部转化为BaCO3;
故答案为:将适量饱和Na2CO3溶液加入BaSO4沉淀中,充分搅拌,静置、弃去上层清液,如此操作,反复多次(直到BaSO4全部转化为BaCO3);
(3)由于高温煅烧要消耗大量能源,还能产生空气污染物,所以与高温煅烧还原法相比相比,(用饱和Na2CO3溶液的)沉淀转化法的优点主要有节约能源,无污染物生成,节能环保;
故答案为:节能,环保等.

|
已知:BaSO4(s)+4C(s)=BaS(s)+4CO(g) △H=+571.2 kJ??mol-1
Ba(s)+S(s)+2O2(g):BaSO4(s) △H=—1473.2 kJ??mol-1
Ba(s)+S(s)=BaS(g) △H=—460 kJ??mol-1
请回答:
(1)工业上煅烧重晶石矿粉时,为使BaSO4得到充分还原和维持反应所需的高温,应采取的措施是 。
(2)沉淀转化法制备BaCO3可用饱和Na2CO3溶液将BaSO4转化为BaCO3:
BaSO4(s)+CO2-3(aq)=BaCO3(s)+SO2-4(aq)
则:在实验室中将少量BaSO4沉淀全部转化为BaCO3的实验操作方法与步骤为
(3)与高温煅烧还原法相比,用饱和Na2CO3溶液沉淀转化法的优点主要有
|
已知:BaSO4(s)+4C(s)=BaS(s)+4CO(g) △H=+571.2 kJ•mol-1
Ba(s)+S(s)+2O2(g):BaSO4(s) △H=—1473.2 kJ•mol-1
Ba(s)+S(s)=BaS(g) △H=—460 kJ•mol-1
请回答:
(1)工业上煅烧重晶石矿粉时,为使BaSO4得到充分还原和维持反应所需的高温,应采取的措施是 。
(2)沉淀转化法制备BaCO3可用饱和Na2CO3溶液将BaSO4转化为BaCO3:
BaSO4(s)+CO2-3(aq)=BaCO3(s)+SO2-4(aq)
则:在实验室中将少量BaSO4沉淀全部转化为BaCO3的实验操作方法与步骤为
(3)与高温煅烧还原法相比,用饱和Na2CO3溶液沉淀转化法的优点主要有

 HS-+OH-
HS-+OH-