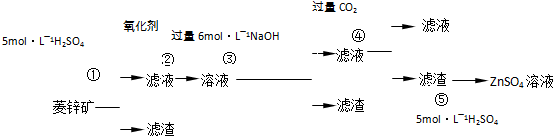
题目内容
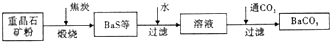
重晶石(BaSO4)难溶于水,要转化成BaCO3再制备其他钡盐.工业上一般采用高温煅烧还原法;实验室可以采用沉淀转化法.
●高温煅烧还原法
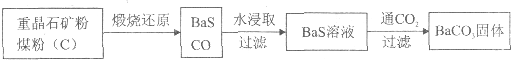
(1)煅烧还原的热化学方程式为 .
有关的数据:Ba(s)+S(s)+202(g)=BaSO4(s)△H=-1.47321kJ?mol-1
C(s)+
02(g)=CO(g)△H=-110.51kJ?mol-1
Ba(s)+S(s)=BaS(s)△H=-460kJ?mol-1
(2)经检验BaS的水溶液呈碱性,原因是(用离子方程式表示) .
●沉淀转化法
BaSO4沉淀中加入饱和Na2CO3溶液,充分搅拌,弃去上层清液.如此处理多次,直到BaSO4全部转化为BaCO3:BaSO4(s)+CO
(aq)?BaCO3(s)+SO42-(aq)(平衡常数K=O.042)
(3)现有0.20mol BaSO4,每次用1.0L 2.0mol?L-1饱和Na2CO3溶液处理,BaSO4能全部转化,至少需要处理多少次?(写出计算过程)
(4)从“绿色化学”角度分析,射饱和Na2CO3溶液沉淀转化法的优点是 .
(5)火力发电厂燃煤排烟,释放出大量的氮氧化物、二氧化碳等气体.某热电厂同时具有烟气脱硝、脱硫、二氧化碳捕集(脱碳)设施,成为高效、节能、绿色环保燃煤电厂.其中脱硝采用催化还原法,C0(NH2)2 (尿素)作还原剂,在加热条件下催化还原氮氧化物,1mol CO(NH2)2反应时失去6mol电子,请写出尿素与二氧化氮反应的化学方程式 .
●高温煅烧还原法

(1)煅烧还原的热化学方程式为
有关的数据:Ba(s)+S(s)+202(g)=BaSO4(s)△H=-1.47321kJ?mol-1
C(s)+
| 1 |
| 2 |
Ba(s)+S(s)=BaS(s)△H=-460kJ?mol-1
(2)经检验BaS的水溶液呈碱性,原因是(用离子方程式表示)
●沉淀转化法
BaSO4沉淀中加入饱和Na2CO3溶液,充分搅拌,弃去上层清液.如此处理多次,直到BaSO4全部转化为BaCO3:BaSO4(s)+CO
2- 3 |
(3)现有0.20mol BaSO4,每次用1.0L 2.0mol?L-1饱和Na2CO3溶液处理,BaSO4能全部转化,至少需要处理多少次?(写出计算过程)
(4)从“绿色化学”角度分析,射饱和Na2CO3溶液沉淀转化法的优点是
(5)火力发电厂燃煤排烟,释放出大量的氮氧化物、二氧化碳等气体.某热电厂同时具有烟气脱硝、脱硫、二氧化碳捕集(脱碳)设施,成为高效、节能、绿色环保燃煤电厂.其中脱硝采用催化还原法,C0(NH2)2 (尿素)作还原剂,在加热条件下催化还原氮氧化物,1mol CO(NH2)2反应时失去6mol电子,请写出尿素与二氧化氮反应的化学方程式
分析:(1)根据盖斯定律结合题目中已知的热化学方程式来计算;
(2)在溶液中,硫离子水解导致溶液显示碱性;
(3)根据化学方程式和化学平衡常数进行计算;
(4)根据所发生的化学反应来判断分析方法的优点;
(5)根据已知反应物和生成物利用元素守恒,结合得失电子守恒书写方程式.
(2)在溶液中,硫离子水解导致溶液显示碱性;
(3)根据化学方程式和化学平衡常数进行计算;
(4)根据所发生的化学反应来判断分析方法的优点;
(5)根据已知反应物和生成物利用元素守恒,结合得失电子守恒书写方程式.
解答:解:(1)a、Ba(s)+S(s)+2O2(g)=BaSO4(s);△H=-1473.2kJ?mol-1
b、C(s)+
O2(g)=CO(g);△H=-110.5kJ?mol-1
c、Ba(s)+S(s)=BaS(s);△H=-460kJ?mol-1,
根据盖斯定律:反应BaSO4(s)+4C(s)=BaS(s)+4CO(g)和a、b、c之间的关系是4b-a+c,
所以BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2 kJ?mol-1,
故答案为:BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2 kJ?mol-1;
(2)在硫化钡中,硫离子水解而使得硫化钡显碱性,即S2-+H2O?HS-+OH-,故答案为:S2-+H2O?HS-+OH-;
(3)设每次用1.00L 2.0 mol?L-1饱和Na2CO3溶液能处理xmol BaSO4,
BaSO4 +CO32-=BaCO3 +SO42
(2.0-x)mol?L-1 x mol?L-1
根据K=
=
=0.042
解得:x=0.081,处理次数=
=2.5,所以至少处理3次;
故答案为:3次;
(4)用饱和Na2CO3溶液沉淀转化法的优点是节能、环保,故答案为:节能,环保;
(5)C0(NH2)2 (尿素)作还原剂,在加热条件下催化还原氮氧化物,根据元素守恒则反应产物为N2、CO2和H2O,1mol CO(NH2)2反应时失去6mol电子,根据得失电子守恒配平方程式为:6NO2+4CO(NH2)2
7N2+4CO2+8H2O,
故答案为:6NO2+4CO(NH2)2
7N2+4CO2+8H2O.
b、C(s)+
| 1 |
| 2 |
c、Ba(s)+S(s)=BaS(s);△H=-460kJ?mol-1,
根据盖斯定律:反应BaSO4(s)+4C(s)=BaS(s)+4CO(g)和a、b、c之间的关系是4b-a+c,
所以BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2 kJ?mol-1,
故答案为:BaSO4(s)+4C(s)=BaS(s)+4CO(g)△H=+571.2 kJ?mol-1;
(2)在硫化钡中,硫离子水解而使得硫化钡显碱性,即S2-+H2O?HS-+OH-,故答案为:S2-+H2O?HS-+OH-;
(3)设每次用1.00L 2.0 mol?L-1饱和Na2CO3溶液能处理xmol BaSO4,
BaSO4 +CO32-=BaCO3 +SO42
(2.0-x)mol?L-1 x mol?L-1
根据K=
| c(SO42-) |
| c(CO32-) |
| x |
| 2.0-x |
解得:x=0.081,处理次数=
| 0.2mol |
| 0.081mol |
故答案为:3次;
(4)用饱和Na2CO3溶液沉淀转化法的优点是节能、环保,故答案为:节能,环保;
(5)C0(NH2)2 (尿素)作还原剂,在加热条件下催化还原氮氧化物,根据元素守恒则反应产物为N2、CO2和H2O,1mol CO(NH2)2反应时失去6mol电子,根据得失电子守恒配平方程式为:6NO2+4CO(NH2)2
| ||
故答案为:6NO2+4CO(NH2)2
| ||
点评:本题考查了学生用盖斯定律计算反应热、盐类水解的离子方程式的书写、化学方程式的书写以及沉淀转化的有关知识,侧重于对学生计算能力的考查,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目