题目内容
【题目】有一结晶水合物x6H2O,可发生如下的转化(部分反应物生成物已略).其中B、D、F均为无色气体,G为难于水的红褐色固体,在A溶液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀.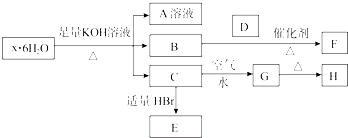
(1)该结晶水合物的化学式为 .
(2)把C溶于过量的稀H2SO4 , 再加KMnO4溶液,所涉及的离子方程式: .
(3)向E溶液中通入等物质的量的Cl2 , 写出反应的离子方程式: .
(4)C→G的现象为 , 该反应的化学方程式为 .
(5)向一定量的Cu与H的混合物中加入300 mL 1 mol/L HCl溶液,恰好使混合物完全溶解,向所得溶液中加入KSCN溶液后无红色出现.若用过量的CO在高温下还原相同质量的此混合物,固体的质量减小g.
【答案】
(1)(NH4)2Fe(SO4)2?6H2O
(2)Fe(OH)2+2H+═Fe2++2H2O、5Fe2++8H++MnO4﹣═5Fe3++Mn2++4H2O
(3)2Fe2++2Br﹣+2Cl2═2Fe3++Br2+4Cl﹣
(4)白色沉淀迅速变成灰绿色,最后变为红褐色;4Fe(OH)2+O2+2H2O═4Fe(OH)3
(5)2.4
【解析】解:结晶水合物中加入KOH溶液生成气体B,则B一定为NH3 , 结晶水合物中含有NH4+ , G为红褐色固体难溶物,说明其为Fe(OH)3 , 则C为Fe(OH)2 , 并说明结晶水合物中含Fe2+;A中加BaCl2溶液生成不溶于稀盐酸的白色沉淀,说明结晶水合物中含有SO42﹣ , 综上所述,结晶水合物为(NH4)2Fe(SO4)26H2O,则H为Fe2O3 , E为FeBr2 . (1)该结晶水合物的化学式为:(NH4)2Fe(SO4)26H2O,所以答案是:(NH4)2Fe(SO4)26H2O;(2)把Fe(OH)2溶于过量的稀H2SO4 , 再加KMnO4溶液,所涉及的离子方程式:Fe(OH)2+2H+═Fe2++2H2O、5Fe2++8H++MnO4﹣═5Fe3++Mn2++4H2O,所以答案是:Fe(OH)2+2H+═Fe2++2H2O、5Fe2++8H++MnO4﹣═5Fe3++Mn2++4H2O;(3)Fe2+的还原性大于Br﹣ , 通入等物质的量Cl2 , 不足以将其全部氧化,先氧化Fe2+ , 再氧化Br﹣ , 反应的离子方程式:2Fe2++2Br﹣+2Cl2═2Fe3++Br2+4Cl﹣ , 所以答案是:2Fe2++2Br﹣+2Cl2═2Fe3++Br2+4Cl﹣;(4)Fe(OH)2变为Fe(OH)3的现象为白色沉淀迅速变成灰绿色,最后变为红褐色,该反应的化学方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)3 , 所以答案是:白色沉淀迅速变成灰绿色,最后变为红褐色;4Fe(OH)2+O2+2H2O═4Fe(OH)3;(5)H为Fe2O3 , 加入盐酸后发生反应依次为①Fe2O3+6HCl═2FeCl3+3H2O,②2FeCl3+Cu═CuCl2+2FeCl2 . 化合物恰好完全溶解,加入KSCN溶液后无红色出现,说明所得溶液溶质为CuCl2和FeCl2 , 原混合物中所含氧元素全部生成水,若用CO还原相同质量的混合物,其质量减少量为氧元素的质量,由题意,HCl的物质的量为0.3mol,结合方程式①,可得所含化合物中所含氧的物质的量等于生成水的物质的量,为0.15mol,其质量为0.15mol×16g/mol=2.4g,固体质量减少2.4g,所以答案是:2.4.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案