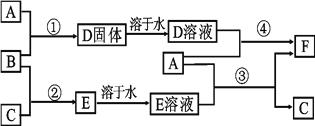
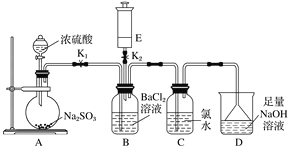
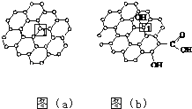
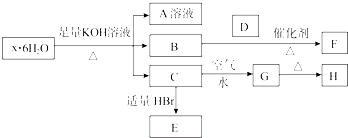
题目内容
【题目】周期表前20号元素中有A、B、C、D、E五种不同主族元素.已知它们原子半径依次增大,其中A与D、C与E原子的电子层数都相差2,且D与E原子的最外层电子数之比为2:1,C与E能形成离子化合物EC.
(1)D元素的原子结构示意图为;
(2)B元素的名称为;
(3)用电子式表示A2C的形成过程;
(4)写出E的碳酸氢盐与足量KOH溶液反应的离子方程式:;
(5)写出EA2与水反应放出气体的化学方程式,并用单线桥表示电子转移方向和数目 .
【答案】
(1)![]()
(2)氟
(3)![]()
(4)Ca2++2HCO3﹣+2OH﹣=CaCO3↓+CO32﹣+2H2O
(5)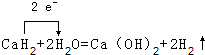
【解析】解:周期表前20号元素中有A、B、C、D、E五种不同主族元素.已知它们原子半径依次增大,其中A与D、C与E原子的电子层数都相差2,D和E不能同时是第三周期的元素,否则A和C都是氢,结合原子半径知E是第四周期的元素中的钾或钙,D是第三周期的元素,A是氢,则E是钙(钾与氢同主族),D与E原子的最外层电子数之比为2:1,则D是硅,结合“C与E能形成离子化合物EC”知C是氧,根据原子半径知B是氟.(1)D为Si元素,原子结构示意图为 ![]() ,故答案为:
,故答案为: ![]() ;(2)B元素的名称为氟,故答案为:氟;(3)用电子式表示H2O的形成过程:
;(2)B元素的名称为氟,故答案为:氟;(3)用电子式表示H2O的形成过程: ![]() ,故答案为:
,故答案为: ![]() ;(4)E的碳酸氢盐与足量KOH溶液反应的离子方程式:Ca2++2HCO3﹣+2OH﹣=CaCO3↓+CO32﹣+2H2O,故答案为:Ca2++2HCO3﹣+2OH﹣=CaCO3↓+CO32﹣+2H2O;(5)CaH2与水反应放出气体,反应化学方程式:CaH2+2H2O=Ca(OH)2+2H2↑,并用单线桥表示电子转移方向和数目为:
;(4)E的碳酸氢盐与足量KOH溶液反应的离子方程式:Ca2++2HCO3﹣+2OH﹣=CaCO3↓+CO32﹣+2H2O,故答案为:Ca2++2HCO3﹣+2OH﹣=CaCO3↓+CO32﹣+2H2O;(5)CaH2与水反应放出气体,反应化学方程式:CaH2+2H2O=Ca(OH)2+2H2↑,并用单线桥表示电子转移方向和数目为: 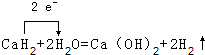 , 故答案为:
, 故答案为: 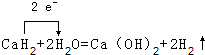 .
.
周期表前20号元素中有A、B、C、D、E五种不同主族元素.已知它们原子半径依次增大,其中A与D、C与E原子的电子层数都相差2,D和E不能同时是第三周期的元素,否则A和C都是氢,结合原子半径知E是第四周期的元素中的钾或钙,D是第三周期的元素,A是氢,则E是钙(钾与氢同主族),D与E原子的最外层电子数之比为2:1,则D是硅,结合“C与E能形成离子化合物EC”知C是氧,根据原子半径知B是氟.

 名校课堂系列答案
名校课堂系列答案【题目】无机化合物可根据其组成和性质进行分类:

(1)上图所示的物质分类方法名称是________。
(2)以H、O、N、S中两种或三种元素组成合适的物质,分别填在下表②③⑥处。
物质类别 | 酸 | 碱 | 盐 | 氧化物 |
化学式 | ①HCl ②____ | ③______ ④Ba(OH)2 | ⑤Na2CO3 ⑥______ | ⑦CO2 ⑧Na2O2 |
(3)过量⑦通入④中反应的离子方程式:______________________________。
(4)设阿伏加德罗常数的值为NA。15.9g ⑤溶于水配制成250mL溶液,CO32-的粒子数为__________,Na+的物质的量浓度为_______________。
(5)上述八种物质中有两种可发生离子反应:NH4++OH-![]() NH3·H2O,其对应的化学反应方程式为____________________________________________________。
NH3·H2O,其对应的化学反应方程式为____________________________________________________。