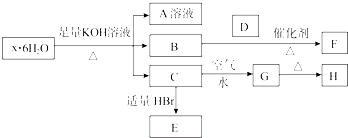
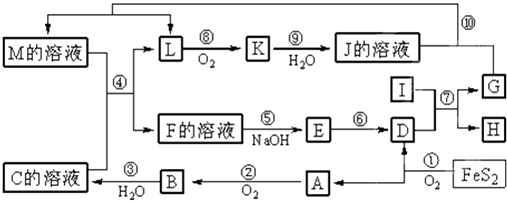
题目内容
【题目】Ⅰ.用![]() 表示原子:
表示原子:
(1)中性原子的中子数:N=______。
(2)阴离子的中子数:AXn-共有x个电子,则N=______。
(3)中性分子中子数:12C16O2分子中,N=______。
(4)A2-原子核内有x个中子,其质量数为m,则n g A2-所含电子的物质的量为____ mol。
Ⅱ.有①![]() 、
、![]() 、
、![]() ②H2、D2、T2 ③石墨、金刚石 ④
②H2、D2、T2 ③石墨、金刚石 ④![]() 、
、![]() 、
、![]() 四组微粒或物质,回答下列问题:
四组微粒或物质,回答下列问题:
(1)互为同位素的是________(填编号,下同)。
(2)互为同素异形体的是________。
(3)有①和④的微粒可组成______种相对分子质量不同的三原子化合物.
【答案】 A-Z A-x+n 22 (m-x+2)n/m ①④ ③ 7
【解析】(1)根据在原子中:质量数=质子数+中子数,所以中子数=质量数-质子数,因此,本题正确答案是:![]() 。
。
(2)根据在阴离子中:核电荷数=质子数=核外电子数-所带电荷数,即核电荷数=质子数![]() ,又根据质量数=质子数+中子数,即中子数=质量数-质子数
,又根据质量数=质子数+中子数,即中子数=质量数-质子数![]() ,因此,本题正确答案是:
,因此,本题正确答案是:![]() ;
;
(3)根据![]() 中核电荷数=质子数=核外电子数=6,再根据
中核电荷数=质子数=核外电子数=6,再根据![]() 中核电荷数=质子数=核外电子数=8,所以
中核电荷数=质子数=核外电子数=8,所以![]() 分子中,电子数为
分子中,电子数为![]() ,因此,本题正确答案是:22;
,因此,本题正确答案是:22;
(4)元素A的质量数为m,![]() 离子的原子核内有x个中子,则A的质子数为
离子的原子核内有x个中子,则A的质子数为![]() ,所以
,所以![]() 中核外电子数为
中核外电子数为![]() ,
,![]() ,
,
则n克![]() 离子中包含电子个数是
离子中包含电子个数是![]() ;
;
因此,本题正确答案是:![]() 。
。
Ⅱ同位素指质子数相同,中子数不同的同一类元素的不同原子,所以①④,互为同素异形体的是指同一元素形成的不同单质,所以③;水分子是由1个氧原子和2个氢原子构成,从氢的三种同位素中选两个氢原子,两个氢原子可以相同也可不同,所以有6种选法;氧原子有3种选法,所以3×6=18,期中相对分子质量不同的三原子化合物由7种;故答案为:①④;③;7。