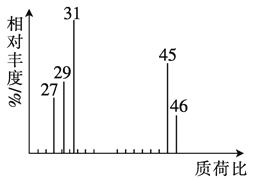
ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩΒγΝΠΙΛ“ΒΥυ–ηΒΡΗ÷÷ΤΙΙΦΰ‘ΎΕΤ–Ω«Α–η“ΣΨ≠ΙΐΥαœ¥Θ§ΤδΜυ±Ψ‘≠άμ «”Ο―ΈΥα≥ΐ»ΞΤδ±μΟφΒΡFe2O3ΓΛH2OΦΑFeOΒ»‘”÷ ΓΘΜΊ ’ΖœΥαΆ§ ±…ζ≤ζΚ§Χζ≤ζΤΖΒΡΝς≥Χ»γœ¬ΘΚ

“―÷ΣΘΚiΘ°Υαœ¥Η÷÷ΤΙΙΦΰΚσΒΟΒΫΖœΥαΒΡ÷ς“Σ≥…Ζ÷»γœ¬±μΥυ ΨΓΘ

ii pH <4 ±Θ§Fe2+≤Μ“Ή±Μ―θΤχ―θΜ·ΓΘ
(1)Υαœ¥Η÷÷ΤΙΙΦΰ ±ΖΔ…ζΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΘΚ2H++ FeO=Fe2++H2OΓΔ_______________ΓΘ
(2)Ιΐ≥ΧII÷–Θ§ΖΔ…ζΒΡ÷ς“ΣΖ¥”ΠΘΚFeCl2(s) °H2SO4(aq) ![]() FeSO4(s)+2HCl( aq)ΓΘ
FeSO4(s)+2HCl( aq)ΓΘ
ΔΌΦ”»κΙΐΝΩH2SO4ΒΡΉς”Ο «_____________Θ®÷Ν…Ό–¥≥ωΝΫΒψΘ©ΓΘ
ΔΎ”ΟΜ·―ßΤΫΚβ‘≠άμΫβ ΆΙΡ»κΩ’ΤχΒΡΡΩΒΡΘΚ_____________ΓΘ
(3)Ιΐ≥ΧIII÷–Θ§FeSO4ΗτΨχΩ’Τχ±Κ…’ΒΟΒΫΒΡΈ≤Τχ÷–Κ§”–ΝΫ÷÷Ω…”Ο”Ύ…ζ≤ζΝρΥαΒΡ―θΜ·ΈοΘ§¥ΥΙΐ≥ΧΖΔ…ζΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ Ϋ «_________________ΓΘ
(4)Ιΐ≥ΧIVΖΔ…ζΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ Ϋ «____________________ΓΘ
(5)Ιΐ≥ΧV:“θάκΉ”ΫΜΜΜ ς÷§Ω…ΫΪFeCl4-―Γ‘ώ–‘ΈϋΗΫΖ÷άκΘ§ΤδΙΐ≥ΧΩ…±μ ΨΈΣROH +X- ![]() RX +OH-ΓΘΒ± ς÷§ΈϋΗΫ±ΞΚΆΚσΩ…÷±Ϋ””ΟΥ°œ¥Β” ς÷§Ϋχ––Ά―ΗΫΘ§Ά§ ±Ά―ΗΫΙΐ≥ΧΖΔ…ζΖ¥”ΠΘΚFeCl4-
RX +OH-ΓΘΒ± ς÷§ΈϋΗΫ±ΞΚΆΚσΩ…÷±Ϋ””ΟΥ°œ¥Β” ς÷§Ϋχ––Ά―ΗΫΘ§Ά§ ±Ά―ΗΫΙΐ≥ΧΖΔ…ζΖ¥”ΠΘΚFeCl4- ![]() Fe3+ +4C1-ΓΘ
Fe3+ +4C1-ΓΘ
ΔΌΈϋΗΫΚσ»ή“ΚΥα–‘œ¬ΫΒΒΡ‘≠“ρ «_______________ΓΘ
ΔΎœ¥Ά―“Κ÷–÷ς“ΣΚ§”–ΒΡ»ή÷ «______________ΓΘ
ΓΨ¥πΑΗΓΩ 6H++Fe2O3ΓΛH2O+Fe==3Fe2++4H2O “÷÷ΤFe2+Υ°ΫβΘΚΖά÷ΙpH >4 ±Θ§Fe2+±Μ―θΤχ―θΜ·ΘΚΧαΙ©H+άϊ”ΎHC1ΤχΧεΒΡ“ί≥ωΘΜΧαΙ©SO42-άϊ”ΎFeSO4ΙΧΧεΈω≥ωΘ®¥π≥ω“‘…œ»Έ“βΝΫΒψΦ¥Ω…Θ© Ω’Τχ¥χΉΏHClΤχΧεΘ§¥ΌΫχΤΫΚβFeCl2(s)+H 2SO4(aq)![]() FeSO4(s)+2HCl(aq)œρ’ΐΖ¥”ΠΖΫœρ“ΤΕ·Θ§”–άϊ”ΎFeSO4ΙΧΧεΒΡΈω≥ω
FeSO4(s)+2HCl(aq)œρ’ΐΖ¥”ΠΖΫœρ“ΤΕ·Θ§”–άϊ”ΎFeSO4ΙΧΧεΒΡΈω≥ω ![]() 2Fe2++ H2O2+8Cl-+ 2H+==2FeCl4-+2H2O άϊ”Ο“θάκ”ΎΩ’ΜΜ ς÷§Ϋχ––ΈϋΗΫ ±Θ§ ς÷§…œΒΡOH-±ΜΫΜΜΜœ¬ά¥Ϋχ»κΈϋΗΫΚσ»ή“ΚΘΜ FeCl3ΚΆHC1
2Fe2++ H2O2+8Cl-+ 2H+==2FeCl4-+2H2O άϊ”Ο“θάκ”ΎΩ’ΜΜ ς÷§Ϋχ––ΈϋΗΫ ±Θ§ ς÷§…œΒΡOH-±ΜΫΜΜΜœ¬ά¥Ϋχ»κΈϋΗΫΚσ»ή“ΚΘΜ FeCl3ΚΆHC1
ΓΨΫβΈωΓΩ(1)Fe2O3ΓΛ2H2O»ήΫβ”ΎœΓ―ΈΥα…ζ≥…¬»Μ·ΧζΘ§Χζ‘Ό”ꬻ̷ΧζΖ¥”Π…ζ≥…¬»Μ·―«ΧζΘ§ΕχFeO»ήΫβ”ΎœΓ―ΈΥα…ζ≥…¬»Μ·―«ΧζΘ§ΖΔ…ζΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣ2H++ FeO=Fe2++H2OΓΔ6H++Fe2O3ΓΛH2O=2Fe3++4H2OΓΔ2Fe3++Fe==3Fe2+Θ§ΚσΕΰΗωΖ¥”ΠΩ…–¥ΉήΖ¥”Π ΫΈΣΘΜ6H++Fe2O3ΓΛH2O+Fe==3Fe2++4H2OΘΜ
(2)ΔΌΙΐ≥ΧII÷–»ή“Κ÷–ΒΡFe2+“ΉΥ°ΫβΓΔ“Ή―θΜ·Θ§‘ρΦ”»κΙΐΝΩH2SO4 «ΈΣΝΥ“÷÷ΤFe2+Υ°ΫβΘΜΖά÷ΙpH >4 ±Θ§Fe2+±Μ―θΤχ―θΜ·ΘΚΧαΙ©H+άϊ”ΎHC1ΤχΧεΒΡ“ί≥ωΘΜΧαΙ©SO42-άϊ”ΎFeSO4ΙΧΧεΈω≥ωΒ»ΘΜ
ΔΎΙΐ≥ΧII÷–άϊ”Ο≤ΜΕœΆ®»κΒΡΩ’Τχ¥χΉΏHClΤχΧεΘ§¥ΌΫχΤΫΚβFeCl2(s)+H 2SO4(aq)![]() FeSO4(s)+2HCl(aq)œρ’ΐΖ¥”ΠΖΫœρ“ΤΕ·Θ§”–άϊ”ΎFeSO4ΙΧΧεΒΡΈω≥ωΘΜ
FeSO4(s)+2HCl(aq)œρ’ΐΖ¥”ΠΖΫœρ“ΤΕ·Θ§”–άϊ”ΎFeSO4ΙΧΧεΒΡΈω≥ωΘΜ
(3)Ιΐ≥ΧIII÷–Θ§FeSO4ΗτΨχΩ’Τχ±Κ…’ΒΟΒΫΒΡΈ≤Τχ÷–Κ§”–ΝΫ÷÷Ω…”Ο”Ύ…ζ≤ζΝρΥαΒΡ―θΜ·ΈοΘ§ΥΒΟς”–SO2ΚΆSO3ΤχΧε…ζ≥…Θ§Ω…÷Σ≤ΩΖ÷SΖΔ…ζΝΥΜΙ‘≠Ζ¥”ΠΘ§‘ρ+2ΦέFe”Π±Μ―θΜ·ΈΣ+3ΦέΘ§Φ¥”–Fe2O3…ζ≥…Θ§Ι FeSO4ΗτΨχΩ’Τχ±Κ…’Ιΐ≥ΧΖΔ…ζΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ Ϋ «2FeSO4![]() Fe2O3+SO3Γϋ+SO2ΓϋΘΜ
Fe2O3+SO3Γϋ+SO2ΓϋΘΜ
(4)Ιΐ≥ΧIV «Υα–‘ΧθΦΰœ¬”ΟH2O2―θΜ·Fe2+ΒΟΒΫ2FeCl4-Θ§ΖΔ…ζΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ Ϋ «2Fe2++ H2O2+8Cl-+ 2H+==2FeCl4-+2H2OΘΜ
(5)ΔΌΗυΨί ROH +X- ![]() RX +OH-Ω…÷ΣΘ§άϊ”Ο“θάκ”ΎΩ’ΜΜ ς÷§Ϋχ––ΈϋΗΫ ±Θ§ ς÷§…œΒΡOH-±ΜΫΜΜΜœ¬ά¥Ϋχ»κΈϋΗΫΚσ»ή“ΚΘ§÷–ΚΆ»ή“Κ÷–ΒΡH+Θ§ Ι»ή“ΚΥα–‘œ¬ΫΒΘΜ
RX +OH-Ω…÷ΣΘ§άϊ”Ο“θάκ”ΎΩ’ΜΜ ς÷§Ϋχ––ΈϋΗΫ ±Θ§ ς÷§…œΒΡOH-±ΜΫΜΜΜœ¬ά¥Ϋχ»κΈϋΗΫΚσ»ή“ΚΘ§÷–ΚΆ»ή“Κ÷–ΒΡH+Θ§ Ι»ή“ΚΥα–‘œ¬ΫΒΘΜ
ΔΎΥ°œ¥ΚσΘ§ΗυΨίFeCl4- ![]() Fe3+ +4C1-Ω…÷ΣΘ§Ήν÷’»ή“Κ÷–÷ς“ΣΚ§”–ΒΡ»ή÷ «FeCl3ΚΆHC1ΓΘ
Fe3+ +4C1-Ω…÷ΣΘ§Ήν÷’»ή“Κ÷–÷ς“ΣΚ§”–ΒΡ»ή÷ «FeCl3ΚΆHC1ΓΘ

 ”≈Β»…ζΧβΩβœΒΝ–¥πΑΗ
”≈Β»…ζΧβΩβœΒΝ–¥πΑΗΓΨΧβΡΩΓΩνήΘ®CoΘ©ΦΑΤδΜ·ΚœΈο‘ΎΙΛ“Β…œ”–ΙψΖΚ”Π”ΟΘ°ΈΣ¥”Ρ≥ΙΛ“ΒΖœΝœ÷–ΜΊ ’νήΘ§Ρ≥―ß…ζ…ηΦΤΝς≥Χ»γœ¬Θ®ΖœΝœ÷–Κ§”–AlΓΔLiΓΔCo2O3ΚΆFe2O3Β»Έο÷ Θ©Θ°

“―÷ΣΘΚΔΌΈο÷ »ήΫβ–‘ΘΚLiFΡ―»ή”ΎΥ°Θ§CoCO3Ρ―»ή”ΎΥ°ΘΜ
ΔΎ≤ΩΖ÷Ϋπ τάκΉ”–Έ≥…«β―θΜ·Έο≥ΝΒμΒΡpHΦϊœ¬±μΘ°
Fe3+ | Co2+ | Co3+ | Al3+ | |
pHΘ®ΩΣ Φ≥ΝΒμΘ© | 1.9 | 7.15 | ©¹0.23 | 3.4 |
pHΘ®Άξ»Ϊ≥ΝΒμΘ© | 3.2 | 9.15 | 1.09 | 4.7 |
«κΜΊ¥πΘΚ
Θ®1Θ©Δώ÷–ΒΟΒΫΚ§¬Ν»ή“ΚΒΡΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ Ϋ « ΓΘ
Θ®2Θ©Δώ÷–ΒΟΒΫνή‘ϋΒΡ Β―ι≤ΌΉς « Θ®Χν≤ΌΉςΟϊ≥ΤΘ©ΓΘ
Θ®3Θ©–¥≥ω≤Ϋ÷ηΔρ÷–Co2O3”κ―ΈΥαΖ¥”Π…ζ≥…Cl2ΒΡάκΉ”ΖΫ≥Χ ΫΘΚ Θ°
Θ®4Θ©≤Ϋ÷ηΔσ÷–ΒςΫΎ»ή“ΚΒΡpH ±Θ§ pHΒΡΖΕΈß « ΓΘ
Θ®5Θ©Ζœ‘ϋ÷–ΒΡ÷ς“Σ≥…Ζ÷”– Θ°
Θ®6Θ©‘ΎΩ’Τχ÷–Φ”»»10.98g≤ίΥανήΨßΧεΘ®CoC2O42H2OΘ©―υΤΖΘ§ ή»»Ιΐ≥Χ÷–≤ΜΆ§Έ¬Ε»ΖΕΈßΡΎΖ÷±πΒΟΒΫ“Μ÷÷ΙΧΧεΈο÷ Θ§Τδ÷ ΝΩ»γ±μΘ°
Έ¬Ε»ΖΕΈß/Γφ | ΙΧΧε÷ ΝΩ/g |
150ΓΪ210 | 8.82 |
290ΓΪ320 | 4.82 |
890ΓΪ920 | 4.5 |
ΔΎΦ”»»ΒΫ210Γφ ±Θ§ΙΧΧεΈο÷ ΒΡΜ·―ß ΫΈΣΘΚ Θ°
ΔέΨ≠≤βΕ®Θ§Φ”»»ΒΫ210ΓΪ310ΓφΙΐ≥Χ÷–ΒΡ…ζ≥…Έο÷Μ”–CO2ΚΆνήΒΡ―θΜ·ΈοΘ§¥ΥΙΐ≥ΧΖΔ…ζΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣΘΚ Θ°Θ°