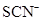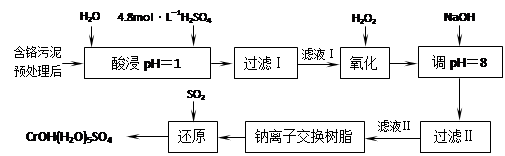题目内容
下列各组离子,在指定的环境中一定能大量共存的离子组是( )
| A.甲基橙呈红色的溶液:NH4+、Na+、SO32-、ClO- |
| B.在能使pH试纸变深蓝色(PH>7)的溶液中:Na+、S2—、NO3—、CO32— |
| C.由水电离出的c(H+)=1×10-13mol/L的溶液中K+、HCO3-、Cl-、S2- |
| D.使PH=0的溶液: Fe2+、NO3-、SO42-、I- |
B
A:甲基橙呈红色说明有大量H+,那么弱酸根SO32-、ClO-不可能大量存在
C:水电离出的c(H+)=1×10-13mol/L,说明水的电离受抑制,可能是强酸性或强碱性溶液,其中HCO3-不可能大量存在
D:PH=0的溶液,即含有大量的H+,NO3—具有强氧化性,可氧化Fe2+、I-
C:水电离出的c(H+)=1×10-13mol/L,说明水的电离受抑制,可能是强酸性或强碱性溶液,其中HCO3-不可能大量存在
D:PH=0的溶液,即含有大量的H+,NO3—具有强氧化性,可氧化Fe2+、I-

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
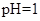 的溶液中W W W K S 5 U . C O M
的溶液中W W W K S 5 U . C O M 、
、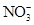 、
、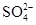 、
、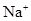
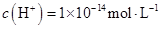 的溶液中:
的溶液中: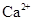 、
、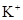 、
、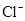 、
、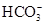
 的溶液中:
的溶液中: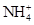 、
、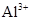 、
、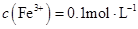 的溶液中:
的溶液中: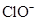 、
、