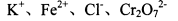题目内容
(1)常温下,0.1 mol·L-1的醋酸和pH=1的醋酸各100 mL分别与足量的锌粒反应,产生的气体前者比后者________(填“多”、“少”或“相等”)。
(2)25℃时,将pH=5的氯化铵溶液稀释100倍,稀释后溶液的pH为________(填字母,下同)。
A.5 B.7 C.3~5之间 D.5~7之间
(3)25℃时,向0.1 mol·L-1的醋酸溶液中加入少量醋酸钠晶体,当晶体溶解后测得溶液的pH将________,醋酸的电离度 ,醋酸的电离平衡常数 ,水的电离程度 。
A.增大 B.减少C.不变 D.无法确定
(4)已知某温度下0.01 mol/L HCl溶液中由水电离的c(H+)=10-11 mol/L,则KW=________;若在此温度下将pH=a的NaOH溶液与pH=b的盐酸按体积比1∶100混合后二者刚好完全反应,a与b应满足的关系为________。
(5)室温下NaHCO3溶液的PH 7(填>、<或=),原因是(用离子方程式表示) ,NaHCO3溶液中离子浓度的大小顺序是
(2)25℃时,将pH=5的氯化铵溶液稀释100倍,稀释后溶液的pH为________(填字母,下同)。
A.5 B.7 C.3~5之间 D.5~7之间
(3)25℃时,向0.1 mol·L-1的醋酸溶液中加入少量醋酸钠晶体,当晶体溶解后测得溶液的pH将________,醋酸的电离度 ,醋酸的电离平衡常数 ,水的电离程度 。
A.增大 B.减少C.不变 D.无法确定
(4)已知某温度下0.01 mol/L HCl溶液中由水电离的c(H+)=10-11 mol/L,则KW=________;若在此温度下将pH=a的NaOH溶液与pH=b的盐酸按体积比1∶100混合后二者刚好完全反应,a与b应满足的关系为________。
(5)室温下NaHCO3溶液的PH 7(填>、<或=),原因是(用离子方程式表示) ,NaHCO3溶液中离子浓度的大小顺序是
(1)少 (2)D (3)A B C A (4) 10-13 , a+b=15
(5) ﹥ , HCO3-+H2O H2CO3+OH- C(Na+)﹥C(HCO3-)﹥C(OH-)﹥C(H+)﹥C(CO32-)
H2CO3+OH- C(Na+)﹥C(HCO3-)﹥C(OH-)﹥C(H+)﹥C(CO32-)
(5) ﹥ , HCO3-+H2O
 H2CO3+OH- C(Na+)﹥C(HCO3-)﹥C(OH-)﹥C(H+)﹥C(CO32-)
H2CO3+OH- C(Na+)﹥C(HCO3-)﹥C(OH-)﹥C(H+)﹥C(CO32-)(1)pH=1的醋酸的物质的量浓度要远大于0.1 mol·L-1,与足量的锌粒反应,产生的氢气要多。
(2)弱酸性溶液稀释后酸性减弱,pH升高,但不会等于或超过7
(3)CH3COOH CH3COO— + H+
CH3COO— + H+
向醋酸溶液中加入少量醋酸钠晶体,平衡左移,电离度减小, H+减小,酸性减小,水的电离程度增大,但电离平衡常数只与温度有关,是不会改变的
(4)某温度下0.01 mol/L HCl溶液中由水电离的c(H+)=10-11 mol/L,则溶液中的c(OH—)=10-11 KW=10-11×10-2 =10-13;由公式:a+b=13+lg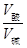 ,即a+b=15
,即a+b=15
(5)考查了酸式盐类的水解,较常见。
(2)弱酸性溶液稀释后酸性减弱,pH升高,但不会等于或超过7
(3)CH3COOH
 CH3COO— + H+
CH3COO— + H+向醋酸溶液中加入少量醋酸钠晶体,平衡左移,电离度减小, H+减小,酸性减小,水的电离程度增大,但电离平衡常数只与温度有关,是不会改变的
(4)某温度下0.01 mol/L HCl溶液中由水电离的c(H+)=10-11 mol/L,则溶液中的c(OH—)=10-11 KW=10-11×10-2 =10-13;由公式:a+b=13+lg
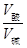 ,即a+b=15
,即a+b=15(5)考查了酸式盐类的水解,较常见。

练习册系列答案
相关题目
 H3O++OH-
H3O++OH-
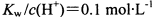 的溶液中
的溶液中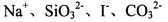
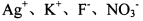
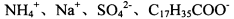
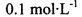 的NaHSO4溶液中
的NaHSO4溶液中