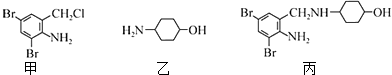
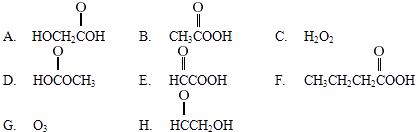题目内容
【题目】一定量的乙醇在氧气不足的情况下燃烧得到CO、CO2和水的总质量为27.6g,若其中水的质量为10.8g,则CO的质量为( )
A.1.4 g
B.2.2 g
C.4.4 g
D.在2.2~4.4 g之间
【答案】A
【解析】解:n(H2O)=10.8g÷18g/mol=0.6mol,
根据H原子守恒,可知乙醇的物质的量= ![]() =0.2mol,
=0.2mol,
根据C原子守恒,可知CO和CO2的总的物质的量=0.2mol×2=0.4mol,
由于水的质量为10.8g,所以一氧化碳和二氧化碳的质量为:27.6g﹣10.8g=16.8g;
令CO、CO2的物质的量分别为xmol、ymol,则:![]()
解得x=0.05,y=0.35,
所以原混合气中CO的质量为0.05mol×28g/mol=1.4g,
故选:A.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】下列实验现象描述错误的是
编号 | 实验 | 现象 |
A | 加热放在坩埚中的小块钠 | 钠先熔化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体 |
B | 在酒精灯上加热用砂纸打磨过的铝箔 | 铝箔变软,失去光泽,熔化的铝并不滴落 |
C | 在FeCl2溶液中滴入NaOH溶液 | 生成白色沉淀,沉淀很快变为灰绿色,最后变为红褐色 |
D | 将水蒸气通过灼热的铁粉 | 黑色粉末变为红褐色 |
A. A B. B C. C D. D