题目内容
【题目】I甲、乙、丙、丁分别是由H+、Na+、Al3+、Ba2+、OH-、Cl-、HCO3- 离子中的两种组成,可以发生如图转化:
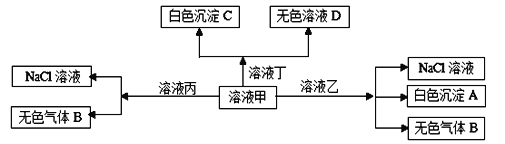
(1)写出无色气体B的一种用途_____________________________。
(2)甲与乙反应的离子方程式为:____________________________。
(3)白色沉淀A可能溶解在溶液D中,其溶解的化学方程式为:________________。
II无水NiCl2在有机合成中有着极为重要的作用,工业上常用含镍原料所制得的NiCl2·6H2O在亚硫酰氯(SOCl2)中加热脱水制得,已知SOCl2能与水反应生成SO2和HCl。写出NiCl2·6H2O在亚硫酰氯(SOCl2)中加热脱水制无水NiCl2的化学方程式___________________________________,NiCl2·6H2O需在亚硫酰氯(SOCl2)中加热脱水的原因是________________________________。
III锰及其化合物用途广泛。锰的化合物有60多种,其中以二氧化锰(MnO2)最稳定。将固体草酸锰(MnC2O4·2H2O)放在一个可以称出质量的容器里加热。固体质量随温度的变化关系如图所示,则:214 ℃时,剩余固体的成分为___________(填化学式); 943 ℃时,剩余固体的成分为__________(填名称)。

【答案】 消防灭火;用于食品行业;用于制碱工业, 在焊接领域可以用作保护气, 作制冷剂等 Al3+ + 3HCO3- == Al(OH)3 ↓+ 3CO2↑ Al(OH)3 + NaOH == NaAlO2 + 2H2O NiCl2·6H2O+6SOCl2![]() NiCl2+6SO2↑+12HCl NiCl2在加热过程中会因发生水解而得不到无水NiCl2,当NiCl2·6H2O在亚硫酰氯(SOCl2)中加热脱水时,反应过程中产生的HCl能抑制NiCl2的水解 MnC2O4 二氧化锰
NiCl2+6SO2↑+12HCl NiCl2在加热过程中会因发生水解而得不到无水NiCl2,当NiCl2·6H2O在亚硫酰氯(SOCl2)中加热脱水时,反应过程中产生的HCl能抑制NiCl2的水解 MnC2O4 二氧化锰
【解析】I、根据这些离子的性质,结合转化关系,分析确定只有HCO3—能生成气体,即与H+反应生成CO2、或者水解生成CO2,所以确定甲为NaHCO3,乙为AlCl3,丙为HCl,丁为Ba(OH)2。(1)CO2是常用的灭火剂,还可用于制碱工业,或在焊接领域用作保护气等;(2) NaHCO3溶液与AlCl3溶液反应的离子方程式为Al3+ + 3HCO3- == Al(OH)3 ↓+ 3CO2↑;(3)白色沉淀A是Al(OH)3,而溶液D为NaOH或Na2CO3,能与Al(OH)3反应的是NaOH,所以反应的化学方程式为Al(OH)3+NaOH == NaAlO2+2H2O。
II、SOCl2能与水反应生成SO2和HCl,可使NiCl2·6H2O中的水脱去,而生成的HCl能够抑制NiCl2的水解,制得无水NiCl2,反应的化学方程式为NiCl2·6H2O+6SOCl2![]() NiCl2+6SO2↑+12HCl。
NiCl2+6SO2↑+12HCl。
III、根据图象中的坐标数据可列关系式如下: ![]() =
=![]() 求得M1=143,M2=87,已知M(MnC2O4)=143g/mol,M(MnO2)=87g/mol,所以214 ℃时,剩余固体的成分为MnC2O4,943 ℃时,剩余固体的成分为MnO2。
求得M1=143,M2=87,已知M(MnC2O4)=143g/mol,M(MnO2)=87g/mol,所以214 ℃时,剩余固体的成分为MnC2O4,943 ℃时,剩余固体的成分为MnO2。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案