题目内容
【题目】I.过氧化钡常温下缓慢分解,不溶于水,常用作氧化剂、漂白剂等。请回答下列问题:
(1)BaO2的电子式为 __________________。
(2)BaCl2在氨水中与H2O2反应可得到BaO2沉淀,用一个离子反应方程式表示该原理为__________________________________________。
(3)配平下列反应方程式: (____)MnO4- + ( ) BaO2+= ( ) Ba2++ ( ) Mn2++ ( ) O2+ ( ) H2O
II、化合物甲由三种元素组成,某研究性学习小组按如下流程探究其组成:

已知:气体A能使品红溶液褪色,加热后品红溶液恢复至原色。取少量溶液B,滴加KSCN溶液,发现溶液变为血红色。请推测并回答:
(4)用离子反应方程式解释溶液变为血红色的原因:____________________________。
(5)写出形成溶液C的化学方程式:________________________________________。
(6)写出气体A通入溶液B中,发生氧化还原的离子反应方程式:_______________________。
(7)写出化合物甲的化学式______________________________。
【答案】 ![]() Ba2++H2O2+2NH3H2O=BaO2↓+ 2NH4+ + 2H2O 2MnO4-+5BaO2+16H+=2Mn2++5O2↑+5Ba2++8H2O Fe3++3SCN- = Fe(SCN)3 (写可逆号不扣分) Al2O3+2NaOH=2NaAlO2+H2O 2H2O+2Fe3++SO2=2Fe2++SO42-+4H+ FeAl2S4
Ba2++H2O2+2NH3H2O=BaO2↓+ 2NH4+ + 2H2O 2MnO4-+5BaO2+16H+=2Mn2++5O2↑+5Ba2++8H2O Fe3++3SCN- = Fe(SCN)3 (写可逆号不扣分) Al2O3+2NaOH=2NaAlO2+H2O 2H2O+2Fe3++SO2=2Fe2++SO42-+4H+ FeAl2S4
【解析】I.本题考查电子式的书写、离子反应方程式的书写、氧化还原反应方程式的配平,(1)BaO2的电子式,可以参考Na2O2的电子式,把两个Na+换成Ba2+即可,即BaO2的电子式为![]() ;(2)根据题目中信息,反应物是BaCl2、NH3·H2O、H2O2,生成物是BaO2沉淀、NH4Cl,离子反应方程式为Ba2++2NH3·H2O+2H2O2=BaO2↓+2NH4++2H2O;(3)MnO4-中Mn由+7价→+2价,化合价降低5价,BaO2中O由-1价→0价,共升高2价,最小公倍数为10,即MnO4-的系数为2,BaO2的系数为5,配平其他,即可2MnO4-+5BaO2+16H+=2Mn2++5O2↑+5Ba2++8H2O ;II.本题考查化学工艺流程,涉及化学反应原理,(4)加入KSCN溶液,溶液变红,说明含有Fe3+,离子方程式为Fe3++3SCN-=Fe(SCN)3;(5)根据流程,固体乙中有能与NaOH反应的元素,即含有铝元素,乙是甲在空气中煅烧得到,因此乙中含有氧化铝,即与NaOH反应的方程式为Al2O3+2NaOH=2NaAlO2+H2O;(6)气体A能使品红溶液褪色,加热后品红溶液恢复至原色,说明此气体为SO2,溶液B中含有Fe3+,因此发生2H2O+2Fe3++SO2=2Fe2++SO42-+4H+ ;(7)根据上述分析,甲有三种元素组成,这三种元素是Al、Fe、S,气体A为SO2,因此甲中S的质量为896×10-3×32/22.4g=1.28g,其S原子的物质的量为0.04mol,甲在空气煅烧得到的是Fe2O3和Al2O3,即残留物D为Fe2O3,Fe的物质的量为0.8×2/160mol=0.01mol,其质量为0.01×56g=0.56g,因此甲中Al的质量为(2.38-0.56-1.28)g=0.54g,其物质的量为0.54/27mol=0.02mol,因此n(Fe):n(Al):n(S)=0.01:0.02:0.04=1:2:4,因此化学式为FeAl2S4。
;(2)根据题目中信息,反应物是BaCl2、NH3·H2O、H2O2,生成物是BaO2沉淀、NH4Cl,离子反应方程式为Ba2++2NH3·H2O+2H2O2=BaO2↓+2NH4++2H2O;(3)MnO4-中Mn由+7价→+2价,化合价降低5价,BaO2中O由-1价→0价,共升高2价,最小公倍数为10,即MnO4-的系数为2,BaO2的系数为5,配平其他,即可2MnO4-+5BaO2+16H+=2Mn2++5O2↑+5Ba2++8H2O ;II.本题考查化学工艺流程,涉及化学反应原理,(4)加入KSCN溶液,溶液变红,说明含有Fe3+,离子方程式为Fe3++3SCN-=Fe(SCN)3;(5)根据流程,固体乙中有能与NaOH反应的元素,即含有铝元素,乙是甲在空气中煅烧得到,因此乙中含有氧化铝,即与NaOH反应的方程式为Al2O3+2NaOH=2NaAlO2+H2O;(6)气体A能使品红溶液褪色,加热后品红溶液恢复至原色,说明此气体为SO2,溶液B中含有Fe3+,因此发生2H2O+2Fe3++SO2=2Fe2++SO42-+4H+ ;(7)根据上述分析,甲有三种元素组成,这三种元素是Al、Fe、S,气体A为SO2,因此甲中S的质量为896×10-3×32/22.4g=1.28g,其S原子的物质的量为0.04mol,甲在空气煅烧得到的是Fe2O3和Al2O3,即残留物D为Fe2O3,Fe的物质的量为0.8×2/160mol=0.01mol,其质量为0.01×56g=0.56g,因此甲中Al的质量为(2.38-0.56-1.28)g=0.54g,其物质的量为0.54/27mol=0.02mol,因此n(Fe):n(Al):n(S)=0.01:0.02:0.04=1:2:4,因此化学式为FeAl2S4。

【题目】实验室制备1,2-二溴乙烷的原理:
CH3CH2OH![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O
CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据列表如下:
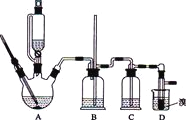
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/gcm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
(1)在反应中若加热后发现未加沸石,应采取的正确方法是________________;判断该制备反应已经结束的最简单方法是_________________。
(2)装置C中应加入______________,吸收反应中产生的某些有影响的杂质气体(填写正确选项前的字母)
a.水 b.浓硫酸 c.NaOH溶液 d.KMnO4溶液
(3)装置B中竖直的长导管起安全管的作用,其原理是_____________。
(4)若产物中有少量Br2,最好用_________洗涤除去(填写正确选项前的字母)
a.水 b.乙醇 c.KI溶液 d.NaHSO3溶液
发生反应的化学方程为____________________。
(5)若产物中有少量副产物乙醚,可用__________的方法除去。
(6)反应过程中应用冷水冷却装置D,主要目的是__________________,但又不能过度冷却(如用冰水),其原因是_________________。

