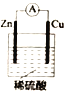
题目内容
【题目】由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀,若用如下图所示实验装置可制得纯净的Fe(OH)2沉淀。两极材料分别是为石墨和铁。

试完成下列问题:
(1)a电极材料是_____。电解质溶液d若为______(填字母),则白色沉淀在电极上生成,此时a电极的电极反应式为_________________________;电解质溶液d若为____(填字母),则白色沉淀在两极之间的溶液中生成,若这种情况下,电路中有0.4mol电子通过,则理论上生成Fe(OH)2的质量为_______g。
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(2)液体c为苯,所起的作用是__________________________,在加入苯之前,对d溶液进行加热处理的目的是__________________。
(3)若d改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接电源,继续电解,除了电极上看到气泡外,另一明显现象为________,发生反应的方程式为__________________。
【答案】 Fe C Fe-2e-+2OH-=Fe(OH)2 B 18g 隔绝空气,防止产物被氧化 赶尽溶液中的氧气 白色沉淀迅速变为灰绿色,最后变为红褐色 4Fe(OH)2+O2+2H2O=4Fe(OH)3
【解析】(1)制纯净的Fe(OH)2沉淀,则a与电源正极相连,Fe为阳极,失去电子,电解质溶液d若为NaOH溶液,则白色沉淀在电极上生成,此时a电极的电极反应式为Fe-2e-+2OH-=Fe(OH)2;电解质溶液d若为NaCl溶液,则白色沉淀在两极之间的溶液中生成,若这种情况下,电路中有0.4mol电子通过,则理论上生成Fe(OH)2的质量为0.4mol×![]() ×90g/mol=18g;(2)苯的密度水的小,不溶于水,可隔绝空气,防止氢氧化亚铁被氧化,为防止氢氧化亚铁被氧化,并在实验加入苯之前,对d溶液进行加热处理的目的是排出溶液中的氧气;(3) 当电解一段时间,看到白色沉淀后,再反接电源继续电解,则此时阳极不再是铁,而是溶液中的OH-放电生成氧气,生成的O2会将Fe(OH)2氧化,其现象是白色沉淀迅速变为灰绿色,最终变为红褐色;发生反应的方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。
×90g/mol=18g;(2)苯的密度水的小,不溶于水,可隔绝空气,防止氢氧化亚铁被氧化,为防止氢氧化亚铁被氧化,并在实验加入苯之前,对d溶液进行加热处理的目的是排出溶液中的氧气;(3) 当电解一段时间,看到白色沉淀后,再反接电源继续电解,则此时阳极不再是铁,而是溶液中的OH-放电生成氧气,生成的O2会将Fe(OH)2氧化,其现象是白色沉淀迅速变为灰绿色,最终变为红褐色;发生反应的方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。

 快乐5加2金卷系列答案
快乐5加2金卷系列答案【题目】据报道:研究人员破解了北京及华北地区雾霾主要成分硫酸盐的形成之谜,发现在大气细颗粒物吸附的水分中NO2与SO2的化学反应是当前雾霾期间硫酸盐的主要生成路径。某实验小组对NO2和SO2的反应进行探究。
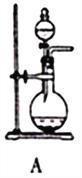

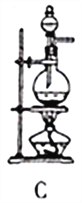
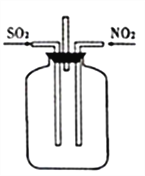
图Ⅰ 图Ⅱ
(1)SO2的发生装置可以选择图Ⅰ中的_______(填字母),反应的化学方程式为___________________。
(2)按图Ⅱ所示进行实验。
①实验时往集气瓶中通入等体积的SO2和NO2,观察到集气瓶中有白烟产生,通入的NO2气体颜色变浅,该反应的化学方程式为______________________。如果集气瓶中有少量水,则可能观察不到白烟,其原因是____________。
②请指出图Ⅱ装置设计的不合理之处___________。
(3)硫酸铵是我国pm2.5雾霾的主要成分,收集一定量的雾霾固体进行验证:
操作步骤 | 实验现象 | 结论 |
取一定量的雾霾固体于试管中,加入适量的水溶解,把溶液分成两份。 | ||
一份___________。 | 有白色沉淀生成。 | 证明雾霾固体中含有SO42- |
另一份___________。 | ___________。 | 证明雾霾固体中含有NH4+。综合上面实验,说明雾霾固体颗粒中含有(NH4)2SO4。 |
【题目】如表所示,提纯下列物质(括号内为杂质),所用除杂试剂和分离方法都正确的是
序号 | 不纯物 | 除杂试剂 | 分离方法 |
A | 苯中的少量苯酚 | NaOH溶液 | 分液 |
B | CH4(C2H4) | 酸性KMnO4溶液 | 洗气 |
C | 福尔马林(甲酸) | NaOH溶液 | 分液 |
D | 乙酸乙酯(乙酸) | 饱和的碳酸钠溶液 | 过滤 |
A. A B. B C. C D. D