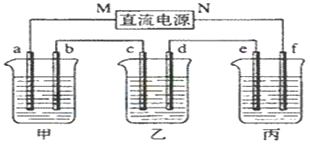
题目内容
【题目】一定量的混合气体在密闭容器中发生如下反应:mA(g)+nB(g)![]() pC(g)+qD(g),达到平衡后,温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度由0.15 mol·L-1变为原来的0.20mol·L-1,则下列叙述正确的是
pC(g)+qD(g),达到平衡后,温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度由0.15 mol·L-1变为原来的0.20mol·L-1,则下列叙述正确的是
A. m+n>p+q B. m+n<p+q
C. 平衡向正反应方向移动 D. C的体积分数增大
【答案】B
【解析】一定量的混合气体在密闭容器中发生如下反应:mA(g)+nB(g)![]() pC(g)+qD(g),达到平衡后,温度不变,将气体体积缩小到原来的一半,不考虑平衡移动,各物质浓度因为体积变化为2倍,C的浓度为原来的2倍;题干中当达到新平衡时,C的浓度由0.15 mol·L-1变为原来的0.20mol·L-1,达不到原来的2倍,说明体积变化后平衡发生了移动,依据C浓度变化可知,平衡左移,根据平衡移动原理分析,逆方向是气体体积减小的反应;依据分析判断,正反应方向是气体体积增大的反应,m+n<p+q,选项A错误,选项B错误;平衡向逆反应方向移动,选项C错误;C的体积分数减小,选项D错误。答案选B。
pC(g)+qD(g),达到平衡后,温度不变,将气体体积缩小到原来的一半,不考虑平衡移动,各物质浓度因为体积变化为2倍,C的浓度为原来的2倍;题干中当达到新平衡时,C的浓度由0.15 mol·L-1变为原来的0.20mol·L-1,达不到原来的2倍,说明体积变化后平衡发生了移动,依据C浓度变化可知,平衡左移,根据平衡移动原理分析,逆方向是气体体积减小的反应;依据分析判断,正反应方向是气体体积增大的反应,m+n<p+q,选项A错误,选项B错误;平衡向逆反应方向移动,选项C错误;C的体积分数减小,选项D错误。答案选B。

 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案【题目】据报道:研究人员破解了北京及华北地区雾霾主要成分硫酸盐的形成之谜,发现在大气细颗粒物吸附的水分中NO2与SO2的化学反应是当前雾霾期间硫酸盐的主要生成路径。某实验小组对NO2和SO2的反应进行探究。
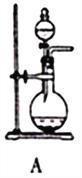

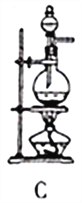
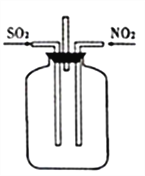
图Ⅰ 图Ⅱ
(1)SO2的发生装置可以选择图Ⅰ中的_______(填字母),反应的化学方程式为___________________。
(2)按图Ⅱ所示进行实验。
①实验时往集气瓶中通入等体积的SO2和NO2,观察到集气瓶中有白烟产生,通入的NO2气体颜色变浅,该反应的化学方程式为______________________。如果集气瓶中有少量水,则可能观察不到白烟,其原因是____________。
②请指出图Ⅱ装置设计的不合理之处___________。
(3)硫酸铵是我国pm2.5雾霾的主要成分,收集一定量的雾霾固体进行验证:
操作步骤 | 实验现象 | 结论 |
取一定量的雾霾固体于试管中,加入适量的水溶解,把溶液分成两份。 | ||
一份___________。 | 有白色沉淀生成。 | 证明雾霾固体中含有SO42- |
另一份___________。 | ___________。 | 证明雾霾固体中含有NH4+。综合上面实验,说明雾霾固体颗粒中含有(NH4)2SO4。 |