题目内容
【题目】常温下,取0.1mol/L的NaA和NaB两种盐溶液各1L,分别通入0.02molCO2,发生如下反应:NaA+CO2+H2O=HA+NaHCO3、2NaB+CO2+H2O=2HB+Na2CO3。在1LHA和HB的溶液分别加水稀释至体积为VL时可能有如图曲线,则下列说法正确的是( )
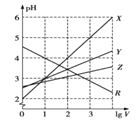
A.X是HA,Y是HB
B.常温下pH:NaA溶液>NaB溶液
C.若常温下,浓度均为0.1mol/L的NaA和HA的混合溶液pH>7,则c(A-)>c(HA)
D.在等浓度的NaA和NaB混合溶液中通入HCl至中性时,c(Cl-)=c(HA)+c(HB)
【答案】D
【解析】
已知NaA+CO2+H2O=HA+NaHCO3、2NaB+CO2+H2O=2HB+Na2CO3,则酸性:H2CO3>HA>HCO3->HB,加水稀释,促进弱酸的电离,酸性越弱,溶液稀释时pH变化越小,所以加水稀释相同的倍数时,pH变化小的是HB,由图中数据可知,X表示的是强酸,则Z为HB、Y为HA,据此分析。
A. 加水稀释相同的倍数时,酸溶液pH增大,pH变化小的是HB,则Z为HB, A错误
B. 酸性:H2CO3>HA>HCO3->HB,酸性越弱的酸,对应阴离子水解程度越大,反之越小,故常温下相同浓度的两种溶液的pH:NaA溶液<NaB溶液, B错误;
C. 若常温下浓度均为0.1mol/L的NaA和HA的混合溶液的pH>7,溶液显碱性,说明A-离子水解程度大于HA电离程度,则c(A-)<c(HA),C错误;
D. 在等浓度的NaA和NaB混合溶液中通入HCl至中性,c(H+)=c(OH-),根据物料守恒可知,c(Cl-)=c(HA)+c(HB),D正确;
答案为D。

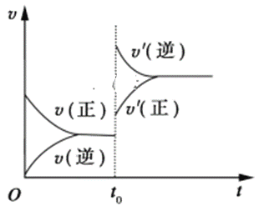
【题目】Ⅰ.已知某可逆反应:aA(g)+bB(g) ![]() cC(g)+dD(g)。请回答下列问题:
cC(g)+dD(g)。请回答下列问题:

(1)根据实验测定结果,描绘出了该反应达到平衡状态时及改变外界条件后,反应速率与时间的关系图像(如图1所示),有利于提高D产量的变化过程是图像中的______段;引起该变化过程的外界条件是_________________________________________。
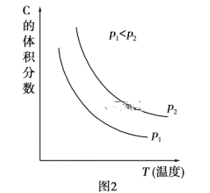
(2)根据实验测定结果描绘出了图2。由此图像可以得出,升高温度,上述平衡将向____(填“正反应”或“逆反应”)方向移动;反应计量数之间的关系:a+b______c+d(填“大于”、“小于”、“等于”或“不确定”)。
Ⅱ.工业合成氨反应如下:N2+3H2![]() 2NH3。请回答下列问题:
2NH3。请回答下列问题:
(1)在一定条件下2L的密闭容器中进行实验,并测得下列数据:
物质 | N2 | H2 | NH3 |
起始(mol) | 2 | 7 | 0 |
10s(mol) | 1.6 | ||
平衡时(mol) | 2 |
则10s内,用氢气表示的化学反应速率是______,该反应的化学平衡常数是________。
(2)根据混合气体各成分的物质性质,你认为工业上将氨气从混合气体中分离出来的措施是________,从而达到反应气体循环利用的目的。实验室检验氨气的方法是__________。