题目内容
5.今有36.5g10%的盐酸与40g一定溶质质量分数的氢氧化钠溶液恰好完全反应,把反应后的溶液蒸发掉54.4g水后,再冷却到20℃时,溶液恰好达到饱和.求20℃时此反应生成物的溶解度.分析 依据反应的盐酸的质量及反应的方程式可以求出生成的氯化钠的质量,再根据质量守恒求出溶剂的质量,然后根据溶解度公式,可求20℃时该物质的溶解度,以此分析解答.
解答 解:设生成氯化钠的质量为x,
36.5g10%的盐酸中溶质的质量为:36.5g×10%=3.65g,
NaOH+HCl=NaCl+H2O
36.5 58.5
3.65g x
$\frac{36.5}{3.65g}=\frac{58.5}{x}$
解之得:x=5.85g
反应后溶液中水的质量为 36.5g+40g-5.85g=70.65g
所以20℃时此反应生成物的溶解度 100g×$\frac{58.5g}{70.65g-54.4g}$=36g,
答:20℃时此反应生成物的溶解度为36g.
点评 此题借助化学反应方程式对物质的溶解度的考查,解题的关键是能够对反应后溶液中溶质质量的解答,从而求出各组分的量,然后根据溶解度公式计算即可,比较容易.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.下列离子方程式正确的是( )
| A. | 氯化铝溶液中加入过量氨水:Al3++3NH3.H2O=Al(OH)3↓+3NH4+ | |
| B. | 碳酸钙和盐酸反应:CO32-+2H+=CO2↑+H2O | |
| C. | 三氯化铁溶液与氢氧化钠溶液反应:FeCl3+3OH-=Fe(OH)3↓+3Cl- | |
| D. | 铜加入稀硝酸中:Cu+4H++NO3-=Cu2++NO↑+2H2O |
3.可以用来鉴别乙烷和乙烯,还可以用来除去乙烷中乙烯的操作方法是( )
| A. | 将混合气体通过盛有浓硫酸的洗气瓶 | |
| B. | 将混合气体通过盛有水的洗气瓶 | |
| C. | 将混合气体通过盛有足量溴水的洗气瓶 | |
| D. | 将混合气体通过盛有澄清石灰水的洗气瓶 |
10.下列说法中,正确的是( )
| A. | 研究有机物一般要经过的基本步骤是:确定实验式→确定分子式→确定结构式→分离、提纯 | |
| B. | 石油的分馏、裂化、裂解和煤的干馏、液化、气化都是物理变化 | |
| C. | “三大合成材料”一般是指塑料、合成纤维、合成橡胶 | |
| D. | 糖类、油脂、蛋白质并不都是高分子化合物,但都可以在一定条件下发生水解反应 |
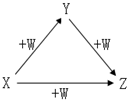 X、Y、Z、W有如图所示的转化关系,则X、Y可能是( )
X、Y、Z、W有如图所示的转化关系,则X、Y可能是( )