题目内容
15.下列离子方程式正确的是( )| A. | 氯化铝溶液中加入过量氨水:Al3++3NH3.H2O=Al(OH)3↓+3NH4+ | |
| B. | 碳酸钙和盐酸反应:CO32-+2H+=CO2↑+H2O | |
| C. | 三氯化铁溶液与氢氧化钠溶液反应:FeCl3+3OH-=Fe(OH)3↓+3Cl- | |
| D. | 铜加入稀硝酸中:Cu+4H++NO3-=Cu2++NO↑+2H2O |
分析 A.反应生成氢氧化铝和氯化铵;
B.碳酸钙在离子反应中保留化学式;
C.氯化铁完全电离,氯离子实际不参加反应;
D.电子、电荷不守恒.
解答 解:A.氯化铝溶液中加入过量氨水的离子反应为Al3++3NH3.H2O=Al(OH)3↓+3NH4+,故A正确;
B.碳酸钙和盐酸反应的离子反应为CaCO3+2H+=Ca2++CO2↑+H2O,故B错误;
C.三氯化铁溶液与氢氧化钠溶液反应的离子反应为Fe3++3OH-=Fe(OH)3↓,故C错误;
D.铜加入稀硝酸中的离子反应为3Cu+8H++2NO3-3=Cu2++2NO↑+4H2O,故D错误;
故选A.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、复分解反应的离子反应考查,注意电子、电荷守恒的分析及离子反应中保留化学式的物质,题目难度不大.

练习册系列答案
相关题目
5.能在水溶液中大量共存的一组离子是( )
| A. | H+、I-、NO3-、CO32- | B. | NH4+、Fe3+、OH-、Br- | ||
| C. | K+、Cl-、Cu2+、NO3- | D. | Al3+、SO42-、Na+、HCO3- |
6.已知氨的催化氧化法制取硝酸的第一步反应:4NH3+5O2═4NO+6H2O(g),当反应中有m个电子转移时,下列说法正确的是(设NA为阿伏加德罗常数)( )
| A. | 生成水蒸气体积为6.72m/NA L | B. | 参加反应的氨气为m/5 mol | ||
| C. | 生成NO的质量为6mNA g | D. | 发生还原反应的原子数为m/2 个 |
3.下表是元素周期表的一部分,针对表中所列标号为①~⑩的元素回答下列问题.
(1)非金属性最强的元素是F(填元素符号),形成化合物种类最多的元素是C(填元素符号).
(2)第三周期元素除⑩外原子半径最小的是Cl(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是NaOH(填化学式),具有两性的是Al(OH)3(填化学式).
(3)⑤⑥⑦三元素的金属性强弱顺序为Na>Mg>Al(填元素符号),判断的实验依据是单质与水或酸反应的剧烈程度(写出一种).
(4)元素⑨的原子结构示意图为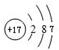 ;元素③的最低价氢化物的电子式为
;元素③的最低价氢化物的电子式为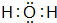 .
.
| 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)第三周期元素除⑩外原子半径最小的是Cl(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是NaOH(填化学式),具有两性的是Al(OH)3(填化学式).
(3)⑤⑥⑦三元素的金属性强弱顺序为Na>Mg>Al(填元素符号),判断的实验依据是单质与水或酸反应的剧烈程度(写出一种).
(4)元素⑨的原子结构示意图为
 ;元素③的最低价氢化物的电子式为
;元素③的最低价氢化物的电子式为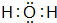 .
.
10.下列反应中,属于加成反应的是( )
| A. | CH2═CH2+HCl→CH3CH2Cl | B. |  +HO-NO2$→_{55~60℃}^{浓H_{2}SO_{4}}$ +HO-NO2$→_{55~60℃}^{浓H_{2}SO_{4}}$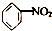 +H2O +H2O | ||
| C. | nCH2═CH2$\stackrel{一定条件}{→}$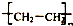 | D. | (C6H10O5)n+nH2O$\stackrel{一定条件}{→}$nC6H12O6 |
20.下列物质的水溶液呈碱性的是( )
| A. | FeCl3 | B. | KSCN | C. | CH3COOH | D. | NH4Al(SO4)2 |
7.下列分散系中分散质微粒直径在1nm~100nm之间的是( )
| A. | 溶液 | B. | 胶体 | C. | 悬浊液 | D. | 乳浊液 |
4.下列物质中,属于电解质的是( )
| A. | 浓氨水 | B. | 碳酸钠 | C. | 稀硫酸 | D. | 金属铁 |