题目内容
【题目】为探索工业中含有铝、铁、铜的合金废料的再利用,某同学设计了如下回收方案:
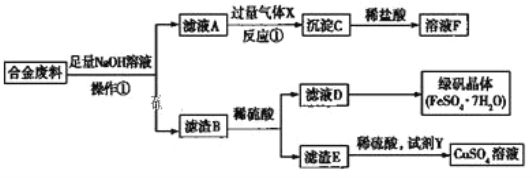
![]() 操作
操作![]() 的名称是___________,滤渣B含有_______________________ (填化学式)。
的名称是___________,滤渣B含有_______________________ (填化学式)。
![]() 合金废料与NaOH溶液反应的化学方程式:____________________________________;
合金废料与NaOH溶液反应的化学方程式:____________________________________;
![]() 反应
反应![]() 的离子方程式是___________________________________;
的离子方程式是___________________________________;
![]() 若要从滤液D中得到绿矾晶体,必须进行的实验操作是_____________、冷却结晶、过滤、洗涤、干燥,在这一系列操作中没有用到的仪器有_________________(填序号)。
若要从滤液D中得到绿矾晶体,必须进行的实验操作是_____________、冷却结晶、过滤、洗涤、干燥,在这一系列操作中没有用到的仪器有_________________(填序号)。
A.漏斗![]() 坩埚
坩埚![]() 烧杯
烧杯![]() 玻璃棒
玻璃棒
![]() 试剂Y应该是一种____________(填“氧化剂”或“还原剂”),它不可能是______(填序号)。
试剂Y应该是一种____________(填“氧化剂”或“还原剂”),它不可能是______(填序号)。
A.H2O2 B.H2 C.O2 D.Fe
【答案】过滤 Fe、Cu 2Al + 2NaOH +2H2O ![]() 2NaAlO2 +3H2 ↑ CO2 + AlO2-+ 2H2O
2NaAlO2 +3H2 ↑ CO2 + AlO2-+ 2H2O ![]() HCO3- + Al(OH)3↓ 蒸发浓缩 B 氧化剂 BD
HCO3- + Al(OH)3↓ 蒸发浓缩 B 氧化剂 BD
【解析】
Al和NaOH溶液反应生成可溶性的NaAlO2,Cu和Fe与NaOH溶液不反应,所以滤液A中含有NaAlO2,滤渣B是Cu和Fe,B和稀硫酸混合,Fe和稀硫酸反应生成FeSO4,Cu和稀硫酸不反应,所以滤渣E是Cu,D中含有FeSO4,Cu和稀硫酸、试剂Y生成硫酸铜,Y是强氧化剂,且不能引进新的杂质,为H2O2,NaAlO2和CO2反应生成Al(OH)3,所以C是Al(OH)3,Al(OH)3和稀盐酸反应生成AlCl3,溶液F中含有AlCl3,再结合基本操作、物质的性质来分析解答。
Al和NaOH溶液反应生成可溶性的NaAlO2,Cu和Fe与NaOH溶液不反应,所以滤液A中含有NaAlO2,滤渣B是Cu和Fe,B和稀硫酸混合,Fe和稀硫酸反应生成FeSO4,Cu和稀硫酸不反应,所以滤渣E是Cu,D中含有FeSO4,Cu和稀硫酸、试剂Y生成硫酸铜,Y是强氧化剂,且不能引进新的杂质,为H2O2,NaAlO2和CO2反应生成Al(OH)3,所以C是Al(OH)3,Al(OH)3和稀盐酸反应生成AlCl3,溶液F中含有AlCl3,
(1)通过以上知,合金废料加入足量氢氧化钠溶液后进行操作①得到滤液A和滤渣B,则操作的名称为过滤;滤渣B含有Cu和Fe;
(2)合金废料中铝与NaOH溶液反应生成偏铝酸钠和氢气,反应的化学方程式为:2Al + 2NaOH +2H2O ![]() 2NaAlO2 +3H2 ↑;
2NaAlO2 +3H2 ↑;
(3)反应①是NaAlO2和过量CO2反应生成Al(OH)3和NaHCO3,反应的离子方程式为:CO2 + AlO2-+ 2H2O ![]() HCO3- + Al(OH)3↓;
HCO3- + Al(OH)3↓;
(4)若要从滤液D得到绿矾晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、自然干燥,在这一系列操作中用蒸发皿蒸发、用玻璃棒搅拌,在过滤中用玻璃棒引流、用烧杯盛放溶液,所以没有用到的仪器有石棉网,故选B;
(5)试剂Y应该是一种氧化剂,能将铜氧化为铜离子,所以它不可能是H2S或Fe,故选BD。