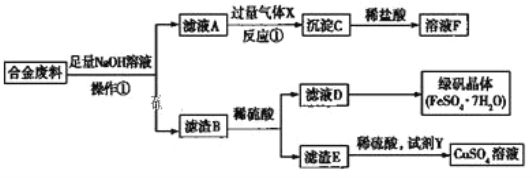
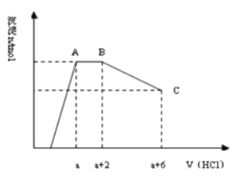
题目内容
【题目】除去氧化镁中的少量氧化铝,可选用( )
A.水B.盐酸
C.氨水D.氢氧化钠溶液
【答案】D
【解析】
A、氧化镁和氧化铝均不溶于水,不能除去氧化铝,故A错误;
B、氧化镁和氧化铝均溶于盐酸,除杂的同时也减少了氧化镁,不符合除杂原则,故B错误;
C、氧化镁和氧化铝均不溶于氨水,不能除去氧化铝,故C错误;
D、氧化镁是碱性氧化物,氧化铝是两性氧化物,加入氢氧化钠溶液,能溶解氧化铝生成偏铝酸钠溶液,同时不能溶解氧化镁,符合除杂原则,故D正确;
故选:D。

练习册系列答案
相关题目
【题目】下列“试剂”和“试管中的物质”不能完成“实验目的”的是

实验目的 | 试剂 | 试管中的物质 | |
A | 羟基对苯环的活性有影响 | 饱和溴水 | ①苯②苯酚溶液 |
B | 甲基对苯环活性有影响 | 酸性KMnO4溶液 | ①苯②甲苯 |
C | 苯分子中没有碳碳双键 | Br2的CCl4溶液 | ①苯②己烯 |
D | 碳酸的酸性比苯酚强 | 石蕊溶液 | ①苯酚溶液②碳酸溶液 |
A. A B. B C. C D. D