题目内容
【题目】无水三氯化铬![]() 在工业上主要用作媒染剂和催化剂。某化学小组在氮气的氛围下用
在工业上主要用作媒染剂和催化剂。某化学小组在氮气的氛围下用![]() 和
和![]() 在高温下制备无水三氯化铬,并测定所制得产品中三氯化铬的质量分数。
在高温下制备无水三氯化铬,并测定所制得产品中三氯化铬的质量分数。
实验原理: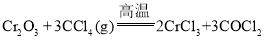
已知:①![]() 熔点为83℃,易潮解,易升华,易溶于水,高温下易被氧气氧化;
熔点为83℃,易潮解,易升华,易溶于水,高温下易被氧气氧化;
②![]() 沸点为57.6℃;
沸点为57.6℃;
③在碱性条件下,![]() 能把
能把![]() 氧化为
氧化为![]() ;
;
在酸性条件下,![]() 能把
能把![]() 还原为
还原为![]() 。
。
回答下列问题:
Ⅰ.氮气的制备
(1)利用工业氮气(混有![]() 、
、![]() 、
、![]() )制取纯净干燥的氮气的实验装置如图1。按气流方向(用小写字母表示)写出其合理的连接顺序:a→________。
)制取纯净干燥的氮气的实验装置如图1。按气流方向(用小写字母表示)写出其合理的连接顺序:a→________。
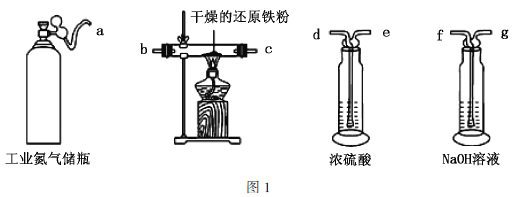
Ⅱ.无水三氯化铬的制备
实验装置如图2所示(加热、夹持等装置已略去)。
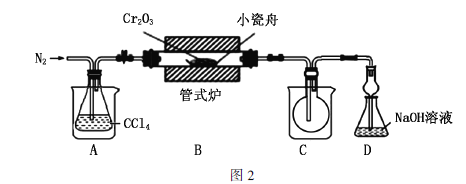
(2)通入![]() 的作用是_____________(写出2点)。
的作用是_____________(写出2点)。
(3)装置A和装置C的烧杯中分别盛放________、________。
(4)制备![]() 时生成的气体
时生成的气体![]() (俗称光气)有毒,
(俗称光气)有毒,![]() 遇水发生水解,反应方程式为
遇水发生水解,反应方程式为![]() 。为了防止污染环境,用足量的NaOH溶液吸收光气,其化学方程式为________________。
。为了防止污染环境,用足量的NaOH溶液吸收光气,其化学方程式为________________。
(5)图2装置中有设计不合理的地方,你认为应该改进的措施有______________。
Ⅲ.产品中![]() 质量分数的测定
质量分数的测定
a.称取![]()
![]() 产品,在强碱性条件下,加入过量的30%
产品,在强碱性条件下,加入过量的30%![]() 溶液,小火加热使
溶液,小火加热使![]() 完全转化为
完全转化为![]() ,继续加热一段时间;
,继续加热一段时间;
b.冷却后加适量的蒸馏水,再滴入适量的浓![]() 和浓
和浓![]() ,使
,使![]() 转化为
转化为![]() ;
;
c.用新配制的![]() 硫酸亚铁铵标准溶液滴至橙红色变浅(反应原理:
硫酸亚铁铵标准溶液滴至橙红色变浅(反应原理:![]() ),加入5滴二苯胺磺酸钠指示剂,继续滴定至溶液由紫蓝色转变为亮绿色且半分钟内不变色即为终点。重复实验3次,平均消耗标准溶液18.00mL。
),加入5滴二苯胺磺酸钠指示剂,继续滴定至溶液由紫蓝色转变为亮绿色且半分钟内不变色即为终点。重复实验3次,平均消耗标准溶液18.00mL。
回答下列问题:
(6)①上述操作a中“继续加热一段时间”的目的是________。
②加浓![]() 的目的是为了防止指示剂提前变色。若不加浓
的目的是为了防止指示剂提前变色。若不加浓![]() ,则测得的
,则测得的![]() 的质量分数将________(填“偏低”、“偏高”或“不变”)。
的质量分数将________(填“偏低”、“偏高”或“不变”)。
③产品中![]() 的质量分数为________%(保留一位小数)。
的质量分数为________%(保留一位小数)。
【答案】![]() 排出空气、吹出
排出空气、吹出![]() 蒸气、吹出
蒸气、吹出![]() 及尾气热水 热水 冷水
及尾气热水 热水 冷水  装置B与C之间的导管可能因
装置B与C之间的导管可能因![]() 凝华而发生堵塞,应换为较粗的导管或者在装置C和D之间连接一个装有无水氯化钙的干燥管(或U形管) 加热使过量
凝华而发生堵塞,应换为较粗的导管或者在装置C和D之间连接一个装有无水氯化钙的干燥管(或U形管) 加热使过量![]() 完全分解,以免在酸性条件下,
完全分解,以免在酸性条件下,![]() 能把
能把![]() 还原为
还原为![]() 偏低 95.1%
偏低 95.1%
【解析】
利用工业氮气(混有![]() 、
、![]() 、
、![]() )制取纯净干燥的氮气,气体的除杂顺序为
)制取纯净干燥的氮气,气体的除杂顺序为![]() 、
、![]() 、
、![]() ,反应前通入氮气是为了排尽装置内的空气,反应中通入氮气,是为了将
,反应前通入氮气是为了排尽装置内的空气,反应中通入氮气,是为了将![]() 蒸出,反应后通入氮气,将残留尾气吹出进行处理,利用氧化还原反应计算质量分数。
蒸出,反应后通入氮气,将残留尾气吹出进行处理,利用氧化还原反应计算质量分数。
⑴利用工业氮气(混有![]() 、
、![]() 、
、![]() )制取纯净干燥的氮气,气体的除杂顺序为
)制取纯净干燥的氮气,气体的除杂顺序为![]() 、
、![]() 、
、![]() ,因此通入顺序
,因此通入顺序![]() ;故答案为:
;故答案为:![]() 。
。
⑵反应前通入氮气是为了排尽装置内的空气,以免![]() 被氧气氧化;反应中通入氮气,是为了将
被氧气氧化;反应中通入氮气,是为了将![]() 蒸气进入硬质玻璃管中参加反应;反应后通入氮气,是为了将硬质玻璃管中的产物吹出以提高产率,并将残留尾气吹出进行处理,避免污染空气;故答案为:排出空气、吹出
蒸气进入硬质玻璃管中参加反应;反应后通入氮气,是为了将硬质玻璃管中的产物吹出以提高产率,并将残留尾气吹出进行处理,避免污染空气;故答案为:排出空气、吹出![]() 蒸气、吹出
蒸气、吹出![]() 及尾气热水。
及尾气热水。
⑶装置A的烧杯中盛放热水使![]() 汽化,装置C的烧杯中盛放冷水使生成的
汽化,装置C的烧杯中盛放冷水使生成的![]() 凝华为固体;故答案为:热水;冷水。
凝华为固体;故答案为:热水;冷水。
⑷可看成光气的水解产物![]() 和HCl分别与足量NaOH反应生成
和HCl分别与足量NaOH反应生成![]() 和NaCl,因此化学方程式为
和NaCl,因此化学方程式为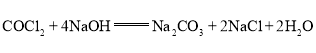 ;故答案为:
;故答案为: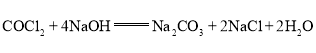 。
。
⑸装置B与装置C之间的导管可能因![]() 凝华而发生堵塞,应该换为较粗的导管。为了防止三氯化铬潮解,在装置C和D之间连接一个盛有碱石灰的干燥管(或U形管);故答案为:装置B与C之间的导管可能因
凝华而发生堵塞,应该换为较粗的导管。为了防止三氯化铬潮解,在装置C和D之间连接一个盛有碱石灰的干燥管(或U形管);故答案为:装置B与C之间的导管可能因![]() 华而发生堵塞,应换为较粗的导管或者在装置C和D之间连接一个装有无水氯化钙的干燥管(或U形管)。
华而发生堵塞,应换为较粗的导管或者在装置C和D之间连接一个装有无水氯化钙的干燥管(或U形管)。
⑹①加热使过量![]() 完全分解,以免在酸性条件下,
完全分解,以免在酸性条件下,![]() 把
把![]() 还原为
还原为![]() ;故答案为:加热使过量
;故答案为:加热使过量![]() 完全分解,以免在酸性条件下,
完全分解,以免在酸性条件下,![]() 能把
能把![]() 还原为
还原为![]() 。
。
②若指示剂提前变色,消耗的标准液体积将偏小,则测得的![]() 含量偏低;故答案为:偏低。
含量偏低;故答案为:偏低。
③由离子方程式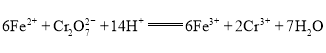 可知
可知
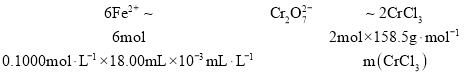
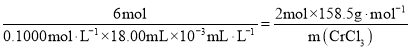 ,
,![]() ,故该实验中
,故该实验中![]() 的质量分数为
的质量分数为![]() ;故答案为:95.1%。
;故答案为:95.1%。

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案【题目】W、X、Y、Z、M、E、Q均为稀有气体外的短周期元素,,其原子序数依次增大,X的最外层电子数是W的4倍,Z与E的最低负化合价相同,X、M在周期表的位置如图。
X | ||
M | E |
(1)Y在周期表中的位置为________,Q的元素名称为_______。
(2)X的最高价氧化物的电子式为____________________;Y和W形成的五核离子的电子式为_________________。
(3)表中元素原子半径最大的是(写元素符号)________。
(4)X与E的最高价氧化物的水化物反应的化学反应式为___________________________。
(5)下列事实能说明Z元素的非金属性比E元素的非金属性强的是________
①Z单质与E的简单氢化物的溶液反应,溶液变浑浊
②在氧化还原反应中,1mol Z单质比1mol E单质得电子多
③Z和E两元素的简单氢化物受热分解,前者分解温度高
(6)M和Q两元素的单质生成1mol M的最高价化合物,恢复至室温,放热687kJ。已知该化合物的溶沸点分别为—69℃和58℃,写出该反应的热化学方程式:_________
(7)铜与一定浓度的硝酸和硫酸的混酸反应,生成的盐只有硫酸铜,同时生成的两种气体由以上元素中的两种元素组成。气体的相对分子质量都小于50,为防止污染,将产生的气体完全转化为最高价含氧酸,消耗1L 2.2mol/L NaOH溶液和1mol O2,则两种气体的分子式以及物质的量分别为____________________,生成的硫酸铜的物质的量为____________