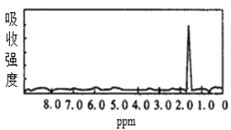
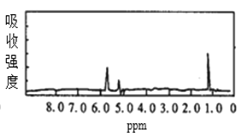
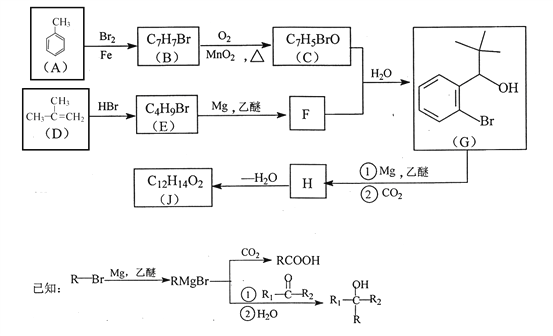
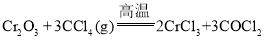题目内容
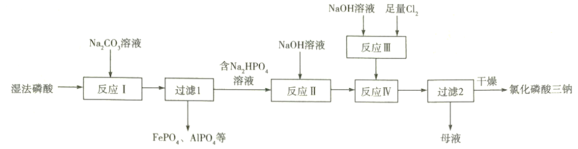
【题目】氯化磷酸三钠![]() 具有良好的灭菌、消毒、漂白作用。湿法磷酸由硫酸分解磷矿石得到,其中含Fe3+、Al3+等杂质。以湿法磷酸为原料制取氯化磷酸三钠的工艺流程如下:
具有良好的灭菌、消毒、漂白作用。湿法磷酸由硫酸分解磷矿石得到,其中含Fe3+、Al3+等杂质。以湿法磷酸为原料制取氯化磷酸三钠的工艺流程如下:
已知:a.温度高时,NaClO易分解。
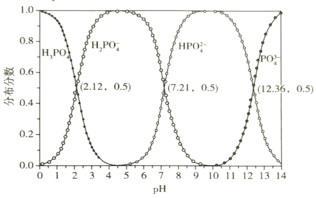
b.常温下,磷酸的物种分布分数与pH的关系如下图所示:
回答下列问题:
(1)硫酸分解Ca5(PO4)3F时产生的有毒气体主要是________________(填化学式)。
(2)反应Ⅰ中磷酸转化为钠盐,其钠盐再与Fe3+、Al3+作用形成沉淀。
①反应Ⅰ中发生多个反应,其中磷酸转化为Na2HPO4的主要离子方程式为___________,常温下应控制pH约为_____________________________。
②常温下,HPO![]() +Fe3+
+Fe3+![]() FePO4+H+的lgK为_________
FePO4+H+的lgK为_________![]() 。
。
(3)反应Ⅱ中不用Na2CO3溶液的原因是____________________________________________;
(4)反应Ⅲ的化学方程式为____________________________________________;
反应Ⅳ中两种溶液混合后需快速冷却,其目的是____________________________;
“母液”中的溶质有NaClO、_____________________(填2种)。
【答案】HF ![]() 10 9.53 Na2CO3溶液的pH难以达到14,不能将Na2HPO4全部转化为Na3PO4,还会引入Na2CO3杂质
10 9.53 Na2CO3溶液的pH难以达到14,不能将Na2HPO4全部转化为Na3PO4,还会引入Na2CO3杂质 ![]() 减少次氯酸钠分解 NaCl、Na3PO4
减少次氯酸钠分解 NaCl、Na3PO4
【解析】
首先利用硫酸分解磷矿石[Ca5(PO4)3F]得到湿法磷酸,其中含Fe3+、Al3+,加入碳酸钠溶液和磷酸反应,反应Ⅰ中磷酸转化为钠盐,其钠盐再与Fe3+、Al3+作用形成沉淀,过滤得到FePO4和AlPO4沉淀,滤液中主要含Na2HPO4;向滤液中加入NaOH溶液,得到Na3PO4;然后加入NaOH和足量氯气反应后的溶液(主要含NaCl和NaClO),由于氯化磷酸三钠溶解度较小,所以会析出氯化磷酸三钠晶体,得到的母液主要含NaCl、NaClO、Na3PO4等。
(1)硫酸分解Ca5(PO4)3F可以得到释放磷酸,该反应应为复分解反应,根据元素守恒,再结合HF为弱酸,可知产生的有毒气体主要是HF;
(2)①碳酸的酸性弱于磷酸,所以加入碳酸钠转化为Na2HPO4的主要离子方程式为![]() ;据图可知pH约为10时,溶液中的P元素主要以
;据图可知pH约为10时,溶液中的P元素主要以![]() 的形成存在;
的形成存在;
②常温下,HPO![]() +Fe3+
+Fe3+![]() FePO4+H+的K=
FePO4+H+的K=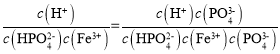 =
=![]() ,所以lgK=lgKa3-lgKsp[FePO4],据图可知当c(
,所以lgK=lgKa3-lgKsp[FePO4],据图可知当c(![]() )=c(PO
)=c(PO![]() )时溶液pH=12.36,而Ka3=
)时溶液pH=12.36,而Ka3=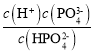 ,所以lgKa3=-12.36,所以lgK=-12.36-(-21.89)=9.53;
,所以lgKa3=-12.36,所以lgK=-12.36-(-21.89)=9.53;
(3)据图可知当pH=14左右时磷元素主要以PO![]() 的形式存在,Na2CO3溶液的pH难以达到14,不能将Na2HPO4全部转化为Na3PO4,还会引入Na2CO3杂质;
的形式存在,Na2CO3溶液的pH难以达到14,不能将Na2HPO4全部转化为Na3PO4,还会引入Na2CO3杂质;
(4)反应III为氯气和NaOH溶液的反应,生成氯化钠和次氯酸钠,方程式为![]() ;NaClO受热易分解,冷却混合液可以减少次氯酸钠的分解;“母液”中的溶质有NaClO、NaCl、Na3PO4。
;NaClO受热易分解,冷却混合液可以减少次氯酸钠的分解;“母液”中的溶质有NaClO、NaCl、Na3PO4。

【题目】50mL 0.50mol·L-1盐酸与50mL 0.55mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
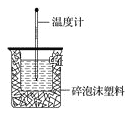
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是_______________,烧杯间填满碎泡沫塑料的作用是_________________。
(2)向盐酸中倒入NaOH溶液的正确操作是:________。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)大烧杯上如果不盖硬纸板,则求得的中和热 ________(填“偏大”、“偏小”或“无影响”)。
(4)两次实验记录的数据如下表:
实验用品 | 溶液温度 | 中和热 | |||
t1 | t2 | ΔH | |||
① | 50mL 0.55mol/L NaOH溶液 | 50mL 0.5mol/L HCl溶液 | 20℃ | 23.3℃ | |
② | 50mL 0.55mol/L NaOH溶液 | 50mL 0.5mol/L HCl溶液 | 20℃ | 23.4℃ | |
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18kJ/(℃·kg),各溶液的密度均为1g/cm3。则中和热ΔH=_________kJ·mol-1。
(5)若改用60mL 0.50mol·L-1 盐酸和50mL 0.55mol·L-1 NaOH溶液进行反应与上述实验相比,所放出的热量_______(填“相等”“不相等”),若实验操作均正确,则所求中和热__________(填“相等”“不相等”)。