题目内容
【题目】下列物质属于电解质的是( )
A.NH3B.O2C.蔗糖D.NaOH固体
【答案】D
【解析】
在水溶液中或熔融状态下可以导电的化合物为电解质。
A.氨气的水溶液虽然可以导电,但其本身不能电离,水溶液导电是因为氨气和水反应生成的一水合氨为弱电解质,氨气不是电解质,故A不选;
B.氧气为单质,既不是电解质也不是非电解质,故B不选;
C.蔗糖在水溶液中和熔融状态下均不导电,是非电解质,故C不选;
D.NaOH固体在水溶液中和熔融状态下均可以导电,为电解质,故D选;
故答案为D。

【题目】二甲醚又称甲醚,简称DME,熔点-141.5℃,沸点-24.9℃,与石油液化气(LPG) 相似,被誉为“21世纪的清洁燃料”。制备原理如下:
I.由天然气催化制备二甲醚:
①2CH4(g)+O2(g)![]() CH3OCH3(g) +H2O(g) △H1=- 283.6 kJ/mol
CH3OCH3(g) +H2O(g) △H1=- 283.6 kJ/mol
II.由合成气制备二甲醚:
②CO(g) +2H2(g)![]() CH3OH(g) △H2=- 90.7 kJ/mol
CH3OH(g) △H2=- 90.7 kJ/mol
③2CH3OH (g)![]() CH3OCH3(g) +H2O(g) △H3
CH3OCH3(g) +H2O(g) △H3
回答下列问题:
(1) 反应③中的相关的化学键键能数据如表:
化学键 | H—H | C—O | H—O(水) | H—O(醇) | C—H |
E/(kJ/mol ) | 436 | 343 | 465 | 453 | 413 |
△H3=_______kJ/mol。
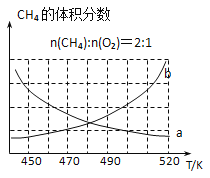
(2) 制备原理I中,在恒温、恒容的密闭容器中合成,将气体按n(CH4): n(O2) =2: 1混合,能正确反映反应①中CH4的体积分数随温度变化的曲线是_______。下列能表明反应①达到化学平衡状态的是________。
a.混合气体的密度不变
b.反应容器中二甲醚的百分含量不变
c.反应物的反应速率与生成物的反应速率之比等于化学计量数之比
d.混合气体的压强不变
(3) 有人模拟制备原理II,在500K时的2L 的密闭容器中充入2mol CO和6mol H2,8min达到平衡,平衡时CO 的转化率为80%,c(CH3OCH3)=0.3mol/L,用H2表示反应②的速率是______;可逆反应③的平衡常数K=_______。若在500K 时,测得容器中n(CH3OH)=n(CH3OCH3),此时反应③v ( 正)______v (逆),说明原因________________。