题目内容
某二元酸(化学式H2A)在水中的电离方程式是:H2A = H+ + HA-,HA- H++A2-,又知0.1mol·L-1NaHA溶液的pH = 2。则下列说法不正确的是
H++A2-,又知0.1mol·L-1NaHA溶液的pH = 2。则下列说法不正确的是
A.因为A2-+H2O HA-+OH-,所以Na2A溶液显碱性
HA-+OH-,所以Na2A溶液显碱性
B.0.1mol·L-1 H2A溶液中氢离子的物质的量浓度为0.11 mol·L-1
C.NaHA溶液中各种离子浓度的关系是c(Na+ ) > c(HA-) > c(H+) > c(A2-) > c(OH-)
D.在NaHA溶液中,HA-电离的趋势大于其水解的趋势
 H++A2-,又知0.1mol·L-1NaHA溶液的pH = 2。则下列说法不正确的是
H++A2-,又知0.1mol·L-1NaHA溶液的pH = 2。则下列说法不正确的是A.因为A2-+H2O
 HA-+OH-,所以Na2A溶液显碱性
HA-+OH-,所以Na2A溶液显碱性B.0.1mol·L-1 H2A溶液中氢离子的物质的量浓度为0.11 mol·L-1
C.NaHA溶液中各种离子浓度的关系是c(Na+ ) > c(HA-) > c(H+) > c(A2-) > c(OH-)
D.在NaHA溶液中,HA-电离的趋势大于其水解的趋势
B
略

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 离子如下表:
离子如下表: )与加NaOH溶液的体积(
)与加NaOH溶液的体积(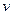 )的关系如右图所示。则该溶液中确定含有的离子有_______________;
)的关系如右图所示。则该溶液中确定含有的离子有_______________;
 关系如下表所示,分析后回答下列问题:
关系如下表所示,分析后回答下列问题: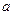 mol
mol 同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯中缓缓注入 Ba(OH)2溶液至恰好完全反应(设H2SO4和Ba(OH)2溶液密度相同)。试回答:
同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯中缓缓注入 Ba(OH)2溶液至恰好完全反应(设H2SO4和Ba(OH)2溶液密度相同)。试回答:
 可知:用酸性KMnO4溶液可检验绿矾
可知:用酸性KMnO4溶液可检验绿矾 是否变质
是否变质 可知:反应中HNO3表现酸性和氧化性
可知:反应中HNO3表现酸性和氧化性 可知:
可知: 的酸性比
的酸性比 强
强 可知:
可知: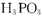 属于三元酸
属于三元酸 小试管各
小试管各 氧化钡溶液中:H++OH-===H2O
氧化钡溶液中:H++OH-===H2O