题目内容
某盐溶液中可能含有NH4+、Ba2+、Na+、Fe2+、Cl—、CO32—、NO3—七种离子中的数种。某同学取4份此溶液样品,分别进行了如下实验:
①用pH试纸测得溶液呈强酸性;
②加入过量NaOH溶液,产生有刺激性气味的气体且有沉淀生成;
③加入硝酸酸化的AgNO3溶液产生白色沉淀;
④加足量BaCl2溶液,没有沉淀产生,在溶液中加入氯水,再滴加KSCN溶液,显红色
该同学最终确定在上述七种离子中肯定含有NH4+、Fe2+、Cl—三种离子。
请分析,该同学只需要完成上述哪几个实验,即可得出此结论。
①用pH试纸测得溶液呈强酸性;
②加入过量NaOH溶液,产生有刺激性气味的气体且有沉淀生成;
③加入硝酸酸化的AgNO3溶液产生白色沉淀;
④加足量BaCl2溶液,没有沉淀产生,在溶液中加入氯水,再滴加KSCN溶液,显红色
该同学最终确定在上述七种离子中肯定含有NH4+、Fe2+、Cl—三种离子。
请分析,该同学只需要完成上述哪几个实验,即可得出此结论。
| A.①②④ | B.①② | C.①②③④ | D.②③④ |
B
正确答案:B
由①溶液呈酸性,溶液中无CO32―,由②溶液中有NH4+ Fe2+ ,无NO3―,阴离子只剩下Cl―肯定有,所以B正确。

练习册系列答案
相关题目
 时
时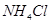 溶液的KW大于
溶液的KW大于 时
时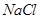 溶液的KW
溶液的KW

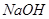 溶液等体积混合,溶液显中性
溶液等体积混合,溶液显中性 答下列问题。
答下列问题。 种盐溶解于水制得,则该盐的化学式为 。
种盐溶解于水制得,则该盐的化学式为 。  H++A2-,又知0.1mol·L-1NaHA溶液的pH = 2。则下列说法不正确的是
H++A2-,又知0.1mol·L-1NaHA溶液的pH = 2。则下列说法不正确的是