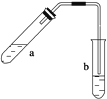
��Ŀ����
����Ŀ����֪�������ݣ�
���� | �۵�(��) | �е�(��) | �ܶ�(g��cm��3) |
�Ҵ� | ��117.0 | 78.0 | 0.79 |
���� | 16.6 | 117.9 | 1.05 |
�������� | ��83.6 | 77.5 | 0.90 |
ijѧ����ʵ������ȡ������������Ҫ�������£�
������2 mLŨ���ᡢ3 mL�Ҵ�(��18O)��2 mL����Ļ����Һ��
�ڰ���ͼ���Ӻ�װ��(װ������������)��������Һ����С����ȼ���3��5 min��
�۴��Թ����ռ���һ���������ֹͣ���ȣ������Թ��Ҳ�������Ȼ���ô��ֲ㡣
�ܷ��������������ϴ�ӡ����
��1�����Ƣ��л����Һ�ķ���Ϊ��
��Ӧ��Ũ�������������
д����ȡ���������Ļ�ѧ����ʽ����
��2������ʵ���б���̼������Һ��������________(����ĸ)��
A.�к�������Ҵ�
B.�к����Ტ�����Ҵ�
C.���������������ܽ�
D.�����������ɣ���������
��3�����������ҪС����ȼ��ȣ�����Ҫ��������
��������۲쵽����������
�������Թ��е����ʷ����Եõ���������������ʹ�õ�������������ʱ����������Ӧ������(��¿ڷš����Ͽڵ���)����
��4����ͬѧ����ʵ�飬�ó��Ҵ�������������͵õ��������������������±���
ʵ�� | �Ҵ�(mL) | ����(mL) | ���� |
�� | 2 | 2 | 1.33 |
�� | 3 | 2 | 1.57 |
�� | 4 | 2 | x |
�� | 5 | 2 | 1.76 |
�� | 2 | 3 | 1.55 |
��������x�ķ�Χ����ʵ��٢ڢ�̽��������
���𰸡�
��1����ŨH2SO4�����Ҵ��У��ӱ���Ȼ���������(���Ƚ��Ҵ��������Ϻ��ټ�Ũ���Ტ�ڼ�������в�����)����������ˮ����CH3COOH+CH3CH218OH![]() CH3CO18OCH2CH3+H2O
CH3CO18OCH2CH3+H2O
��2��B,C
��3�������Ȼᵼ�´�����ԭ����������ʧ�������ݲ�����Һ��ֲ㣬�ϲ�Ϊ��ɫ����ζҺ�壬�²�Ϊdz��ɫҺ�壬���²�Һ����ɫ��dz����Һ©�����Ͽڵ�
��4��1.57��1.76�������Ҵ�����������������IJ�����Ӱ��
��������(1)�����Ũ�����൱�ڱ�ϡ�ͣ���Ӧ��ŨH2SO4�����Ҵ��У�Ȼ��������ᣬҲ���Ƚ��Ҵ��������Ϻú��ټ���Ũ�����������Ӧ��������Ϊ���淴Ӧ��ʹ��Ũ����ɼӿ�������Ӧ�����ʲ�������ƽ�����������ķ����ƶ�(������ˮ)��������Ӧ�Ļ����������ǻ������⣬�����ɵ����к���18O��(2)ʹ�ñ���̼������Һ�������ǣ��ٿɳ�ȥ�������������е����ᣬ�������Ҵ����ڿɽ��������������ܽ�Ȳ�������Һ��ֲ㡣(3)�ɱ�������֪�Ҵ��ķе�(78.0��)�����������ķе�(77.5��)�ܽӽ������ô����ȣ��������Ҵ��ᱻ��������������ԭ�ϵĴ�����ʧ���������ܶ�С��ˮ���ܶȣ����ϲ�Ϊ��״����ζ����ɫҺ�壬�������һ��������������������������Na2CO3��Ӧ�����²�Һ���ɫ��dz�����ֲ��Һ����뿪����ʹ�÷�Һ©������Һʱ�ϲ�Һ��Ӧ���Ͽڵ�����(4)̽���Ҵ������������ĸı�������ʵ�Ӱ���������������ʵ������֪�������Ҵ�������������������������������ӡ�

 ��Կ���Ծ�ϵ�д�
��Կ���Ծ�ϵ�д�����Ŀ��2014��7��31���й����������ӱ�ʡ��չ������������ר�������ж���ǿ�������ϡ�������ij������������Ҫ�ɷ�ΪSiO2��MgO��Al2O3��Fe2O3�ȳɷ֣����շ����еĽ���Ԫ�صĹ���������ͼ��ʾ�� 
��֪�������£����Ͱ�ˮ��pHԼΪ11���������ӳ�������pH���������ʾ��
���� | ������������ʽ��ȫ����ʱ����pH | �������������ȫ�ܽ�ʱ����pH |
Fe3+ | 3.2 | |
A13+ | 5.3 | 11.9 |
Mg2+ | 12.3 |
��1���Լ���Ϊ �� �Լ���Ϊ��
A��AgNO3 B��NaOH C��NH3H2O D��H2SO4
��2������C�Ļ�ѧʽ�� �� ��ҺF�н���Ԫ�صĴ�����ʽΪ��
��3��д������A���Լ��ڷ�Ӧ�Ļ�ѧ����ʽ����F��ͨ�����CO2�����������ӷ���ʽΪ��
��4�������Լ��ڣ�ʵ����ҺD����ҺF��ת�����������Һ��pHΪ ��
A.6
B.10
C.12
D.13
��5��25��ʱ������4������pH������ҺF��c��Mg2+��=5.6��10��10mol/L����������þ��Ksp=��
��6�����һ����Ӧ���漰�������Σ�������ʽ�ε���Һ�и�����Ũ���ɴ�С��˳��Ϊ ��