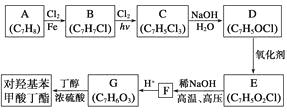
题目内容
【题目】某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析: 
(1)该反应的化学方程式为: .
(2)反应开始至2min,用Z表示的平均反应速率为: .
(3)在下列事实中,什么因素影响了化学反应的速率? ①同浓度、同体积的盐酸中放入大小相同的铁片和镁片产生气体有快有慢:;
②熔化的KClO3放出气泡很慢,加入少量MnO2很快产生气体: .
(4)在密闭容器里,通入a mol X(g)和b mol Y(g),发生反应X(g)+Y(g)2Z(g),当改变下列条件时,反应速率会发生什么变化?(选填“增大”、“减小”或“不变”) ①升高温度,反应速率;
②保持容器体积不变,充入不参加反应的惰性气体,反应速率 .
【答案】
(1)Y+3X?2Z
(2)0.05mol?L﹣1?min﹣1
(3)反应物的性质;催化剂
(4)增大;不变
【解析】解:(1)由图可知,Y、X的物质的量减少,则Y、X为反应物,而Z的物质的量增加,可知Z为生成物,v(Y):v(X):v(Z)=△n(Y):△n(X):△n(Z)=(1﹣0.9):(1﹣0.7):(0.2﹣0)=1:3:2,且2min后物质的量不再变化,由速率之比等于化学计量数之比可知反应为Y+3X2Z,
所以答案是:Y+3X2Z;(2)反应开始至2min,用Z表示的平均反应速率为 ![]() =0.05 molL﹣1min﹣1,
=0.05 molL﹣1min﹣1,
所以答案是:0.05 molL﹣1min﹣1;(3)①同浓度、同体积的盐酸中放入大小相同的铁片和镁片产生气体有快有慢,影响因素为反应物的性质,所以答案是:反应物的性质;
②熔化的KClO3放出气泡很慢,加入少量MnO2很快产生气体,影响因素为催化剂,所以答案是:催化剂; (4)①升高温度,活化分子百分数增大,则反应速率增大,所以答案是:增大;
②保持容器体积不变,充入不参加反应的惰性气体,X、Y、Z的浓度均不变,则反应速率不变,所以答案是:不变.

 名校课堂系列答案
名校课堂系列答案