��Ŀ����
����Ŀ������﮼��仯�����ڹ��ý�������;�㷺��ռ����Ҫ��λ��
��1�����Ԫ�����ڱ��е�λ����
��2������֤��﮵Ľ����������Ƶ�ʵ����ʵ��
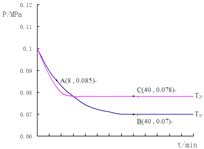
��3����ͼ����ij���±ˮ����Ҫ��Na+��K+��Li+��Mg2+��Clһ�ȣ����еij�﮹���·��ͼ�� 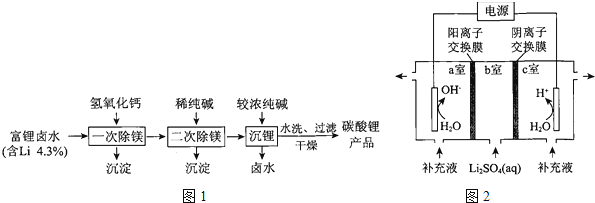
�١����γ�þ�����õij�������Ҫ�м�ʽ̼��þ��
�ڡ���ﮡ��͡����γ�þ��ʱ���ô����Ũ�Ȳ����ԭ����
��4���������Ʊ���̼��﮼������Ƶ��������Һ����������ͼ��ʾװ���Ʊ�������ﱣ�
��̼��������ᷴӦ�����ӷ���ʽ��
�ڽ�ϵ缫��Ӧʽ�����Ƶ�LiOH��ԭ����
�۸÷��п�ѭ�����õ������� ��
���𰸡�
��1���ڶ�����IA��
��2��Na��Li�ֱ���ˮ��Ӧ��Na��ˮ�ķ�Ӧ������
��3��̼��ƣ�̼��﮵��ܽ�ȴ���̼��þ��̼��Ƶ��ܽ�ȣ�ʹLi+������Ҫ����CO32����Ũ��
��4��Li2CO3+2H+=Li++CO2��+H2O��a���з�����Ӧ��2H2O+2e��=H2��+2OH�� �� b��������Ӿ��������ӽ���Ĥ����a�ң�a�������ղ���ΪLiOH��������H2SO4
����������1�����Ԫ�����ڱ��е�λ���ǣ��ڶ�����IA�壬���Դ��ǣ��ڶ�����IA�壻��2��Na��Li�ֱ���ˮ��Ӧ��Na��ˮ�ķ�Ӧ�����ң�֤��﮵Ľ����������ƣ�
���Դ��ǣ�Na��Li�ֱ���ˮ��Ӧ��Na��ˮ�ķ�Ӧ�����ң���3����±ˮ�м����������ƽ���þ����ת��Ϊ������þ�������ټ���ϡ̼������Һ����Һ��þ���ӡ�������ת��Ϊ�����������γ�þ�����õij�������Ҫ�м�ʽ̼��þ��̼��ƣ����Դ��ǣ�̼��ƣ��ڶ��γ�þ����˷��룬��Һ�м���Ũ̼������Һ��ʹ��Һ��Li+ת��Ϊ̼��﮳���������ﮡ��͡����γ�þ��ʱ���ô����Ũ�Ȳ�ͬ��������̼��﮵��ܽ�ȴ���̼��þ��̼��Ƶ��ܽ�ȣ�ʹLi+������Ҫ����CO32����Ũ�ȣ����Դ��ǣ�̼��﮵��ܽ�ȴ���̼��þ��̼��Ƶ��ܽ�ȣ�ʹLi+������Ҫ����CO32����Ũ�ȣ���4����̼��������ᷴӦ��������ﮡ�������̼��ˮ����Ӧ���ӷ���ʽΪ��Li2CO3+2H+=Li++CO2��+H2O�����Դ��ǣ�Li2CO3+2H+=Li++CO2��+H2O������ˮ���������֪��a��Ϊ�����ң�cΪ�����ң�a����ˮ�ŵ緢����Ӧ��2H2O+2e��=H2��+2OH�� �� b��������Ӿ��������ӽ���Ĥ����a�ң����յõ�LiOH��c����ˮ�ŵ����������������ӣ���������Ӿ��������ӽ���Ĥ����c�ң����յõ����
���Դ��ǣ�a���з�����Ӧ��2H2O+2e��=H2��+2OH�� �� b��������Ӿ��������ӽ���Ĥ����a�ң�a�������ղ���ΪLiOH����������c�������ɵ�H2SO4�����ܽ�̼��ﮣ�����ѭ�����ã����Դ��ǣ�H2SO4 ��
�����㾫����������Ĺؼ���������Ԫ�������ɵ�ʵ�ʵ����֪ʶ�����բ�ԭ�Ӻ�����Ӳ��Ų��������Ա仯��������������1��8���������Ա仯����ԭ�Ӱ뾶�������Ա仯��ͬ����Ԫ�ء�����ԭ����������ԭ�Ӱ뾶��С�������Ա仯����Ԫ����Ҫ���ϼ۵������Ա仯������+1��+7�����ۣ�4����1�������Ա仯����Ԫ�صĽ����ԡ��ǽ����Ե������Ա仯���������������ǽ���������ǿ�������Ա仯��