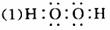题目内容
单质A、B、C在常温下均为气态,分别由甲、乙、丙三种短周期元素组成;已知丙元素的原子结构中次外层电子数比最外层电子数多l,化合物D在常温下呈液态,G是常见的金属单质,H是常见的蓝色沉淀。各物质间的转化关系如下图所示(反应条件多数已略去);
请回答:
(1)反应⑥的离子方程式是
(2)甲、乙两元素除形成化合物D外,还可形成一种含有4个原子核和18个电子的化合物,该化合物的电子式是
(3)在反应①中,已知lgB,完全燃烧生成液态D时,放出142.9KJ的热量,则表示B燃烧热的热化学方程式是
(4)反应①也可以设计成原电池装置进行,当用铂作电极,用KOH溶液作电解质溶液时,负极的电极反应式是
(5)反应③④在通常情况下不能自发进行,框图中的条件a是 ,在使反应③④能够发生的装置中,有一个电极材料必须相同,写出该电极反应式
(1) ![]() (2)
(2) ![]()
(3) ![]() (4)
(4) ![]()
⑸通电电解;![]()
解析:
此题是无机推断题,考查了原子结构元素周期表和原电池电解池的知识。由甲、乙、丙三种短周期元素组成的单质A、B、C常温下是气态,则此三种物质可能是H2、O2、N2、F2、Cl2。丙元素的原子结构中次外层电子数比最外层电子数多1,则丙是氯元素,C为Cl2,A、B反应生成的D,在常温下是液体,则猜测D能是水,A、B是H2 、O2 ,B与Cl2反应生成E,则B是H2,E是HCl,A是O2,H是常见的蓝色沉淀,则H可能是Cu(OH)2 ,H和E反应生成的I是CuCl2,反应的离子方程式是:![]() 。G是常见的金属单质,与C反应可以生成I,则G是Cu,
。G是常见的金属单质,与C反应可以生成I,则G是Cu,
问题⑵甲乙分别是氧和氢,二者除了生成H2O 以外,还可以生成H2O2 ,其电子式是:![]() 。
。
问题⑶:反应①是H2和O2生成水的反应,根据题给信息很容易计算出1molH2的燃烧放出的热量为285.8KJ/mol,则表示B燃烧热的热化学方程式为:![]() 。
。
问题⑷:以铂作电极、KOH溶液为电解质溶液构成原电池时,依据原电池原理很容易判断出正负极上发生反应的物质分别是O2、H2,负极上发生的电极反应是: ![]() 。
。
问题⑸:反应③、④分别是铜与水和盐酸的反应,通常这两个反应不能自发进行,需要在通电电解的条件下才能发生,并且在电极时都需要铜作阳极,发生的反应是![]() 。
。

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案