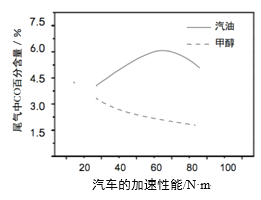
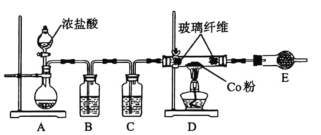
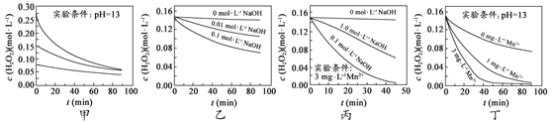
题目内容
【题目】已知2.3克某有机物在氧气中完全燃烧,只生成4.4克二氧化碳和2.7克水。
(1)计算确定该有机物的最简式________。
(2)若该有机物的相对分子质量为46,写出其分子式__________。
【答案】C2H6O C2H6O
【解析】
根据燃烧产生CO2、H2O可确定其中含有C、H两种元素,根据CO2中的C、H2O中的H的质量和与2.3g有机物质量大小判断有机物中是否含有O元素,根据元素的物质的量的比确定实验式,再结合相对分子质量是最简式的整数比来确定有机物分子式。
(1)有机物燃烧产生CO2、H2O,可直接判断有机物含有碳、氢元素,4.4克CO2中含碳元素质量m(C)=![]() ×4.4g=1.2g,n(C)=1.2g÷12g/mol=0.1mol;2.7克H2O中含氢元素质量为m(H)=
×4.4g=1.2g,n(C)=1.2g÷12g/mol=0.1mol;2.7克H2O中含氢元素质量为m(H)=![]() ×2.7g=0.3g,n(H)=0.3g÷1g/mol=0.3mol,1.2g+0.3g=1.5g<2.3g,可判断该有机物还含有氧元素,其质量为m(O)=2.3g-1.5g=0.8g,n(O)=0.8g÷16g/mol=0.05mol,n(C):n(H):n(O)=0.1mol:0.3mol:0.05mol=2∶6∶1,根据N=nNA可知:微粒的物质的量的比等于原子个数比,所以有机物分子中C、H、O原子个数比为2∶6∶1,因此该有机物的最简式为C2H6O;
×2.7g=0.3g,n(H)=0.3g÷1g/mol=0.3mol,1.2g+0.3g=1.5g<2.3g,可判断该有机物还含有氧元素,其质量为m(O)=2.3g-1.5g=0.8g,n(O)=0.8g÷16g/mol=0.05mol,n(C):n(H):n(O)=0.1mol:0.3mol:0.05mol=2∶6∶1,根据N=nNA可知:微粒的物质的量的比等于原子个数比,所以有机物分子中C、H、O原子个数比为2∶6∶1,因此该有机物的最简式为C2H6O;
(2)该有机物最简式是C2H6O,式量是46,等于该有机物的相对分子质量,说明最简式就是分子式,所以有机物的分子式为C2H6O。

【题目】已知A(g)+B(g) ![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 900 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的 ΔH________0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20 mol的A和0.80 mol的B, 反应经一段时间后,达到平衡时A的转化率为________,如果这时向该密闭容器中再充入1 mol氩气,再次达平衡时A的转化率 ________(填“增大”、“减小”或“不变”);
(3)下列选项可作为判断该反应达到平衡的依据是______:
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等
(4)1200 ℃时反应C(g)+D(g) ![]() A(g)+B(g)的平衡常数的值为________。
A(g)+B(g)的平衡常数的值为________。