题目内容
【题目】甲醇作为燃料,在化石能源和可再生能源时期均有广泛的应用前景。
I. 甲醇可以替代汽油和柴油作为内燃机燃料。
(1)汽油的主要成分之一是辛烷[C8H18(l)]。已知:25℃、101 kPa时,1 mol C8H18(l)完全燃烧生成气态二氧化碳和液态水,放出5518 kJ热量。该反应的热化学方程式为______。
(2)已知:25℃、101 kPa时,CH3OH(l) + 3/2 O2(g) ==== CO2 (g) + 2H2O(l) Δ H=-726.5 kJ/mol。相同质量的甲醇和辛烷分别完全燃烧时,放出热量较多的是______。
(3)某研究者分别以甲醇和汽油做燃料,实验测得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如右所示。

根据图信息分析,与汽油相比,甲醇作为燃料的优点是______。
II. 甲醇的合成
(4)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如下图所示。

① 补全上图:图中A处应填入______。
② 该反应需要加入铜-锌基催化剂。加入催化剂后,该反应的ΔH______(填“变大”“变小”或“不变”)。
(5)已知: CO(g)+1/2 O2(g) ==== CO2(g) ΔH1=-283 kJ/mol
H2(g)+1/2 O2(g) ==== H2O(g) ΔH2=-242 kJ/mol
CH3OH(g) + 3/2 O2(g) ==== CO2 (g) + 2H2O(g) ΔH3=-676 kJ/mol
以CO(g)和H2(g)为原料合成甲醇的反应为CO(g) + 2H2(g) ==== CH3OH(g) 。该反应的ΔH为_____ kJ/mol。
【答案】C8H18(l) + 25/2O2(g)=8CO2(g) + 9H2O(l) ΔH=-5518 kJ/mol C8H18 汽车的加速性能相同的情况下,CO排放量低,污染小 1 mol CO2(g) + 3 mol H2(g) 不变 -91
【解析】
(1)根据书写热化学反应方程式的方法书写;
(2)假设质量均为1g,计算出1g CH3OH和1g辛烷完全燃烧放出的热量,再判断;
(3)根据图像可知,甲醇作为燃料时,根据汽车的加速性能与 CO排放量的关系分析解答;
(4)①CO2(g)和H2(g)为原料生成1mol甲醇和1mol水,根据质量守恒分析解答;②根据催化剂与焓变的关系判断;
(5)根据盖斯定律分析解答。
(1)在25℃、101 kPa时,1 mol C8H18(l)完全燃烧生成气态二氧化碳和液态水,放出5518 kJ热量,所以其热化学反应方程式为:C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l)△H=-5518 kJmol-1,故答案为:C8H18(l)+
O2(g)=8CO2(g)+9H2O(l)△H=-5518 kJmol-1,故答案为:C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l)△H=-5518 kJmol-1;
O2(g)=8CO2(g)+9H2O(l)△H=-5518 kJmol-1;
(2)假设质量均为1g,则1g CH3OH完全燃烧放出的热量=![]() =22kJ,1g辛烷完全燃烧放出的热量=
=22kJ,1g辛烷完全燃烧放出的热量=![]() =48kJ,相同质量的甲醇和辛烷分别完全燃烧时,放出热量较多的是C8H18(或辛烷),故答案为:C8H18(或辛烷);
=48kJ,相同质量的甲醇和辛烷分别完全燃烧时,放出热量较多的是C8H18(或辛烷),故答案为:C8H18(或辛烷);
(3)根据图像可知,汽车的加速性能相同的情况下,甲醇作为燃料时CO排放量低,污染小,故答案为:汽车的加速性能相同的情况下,CO排放量低,污染小;
(4)①以CO2(g)和H2(g)为原料合成甲醇,反应生成1mol甲醇和1mol水,根据质量守恒,需要1mol二氧化碳和3mol氢气,因此图中A处应填入1 mol CO2(g) + 3 mol H2(g),故答案为:1 mol CO2(g) + 3 mol H2(g);
②加入催化剂,不能改变反应的焓变,因此Δ H不变,故答案为:不变;
(5)①CO(g)+1/2 O2(g) =CO2(g) Δ H1=-283 kJ/mol ,②H2(g)+1/2 O2(g) = H2O(g) Δ H2=-242 kJ/mol,③CH3OH(g) + 3/2 O2(g) =CO2 (g) + 2H2O(g) Δ H3=-676 kJ/mol,根据盖斯定律,将①+②×2-③,得:CO(g) + 2H2(g) =CH3OH(g) ΔH=(-283 kJ/mol)+(-242 kJ/mol)×2-(-676 kJ/mol)=-91 kJ/mol,故答案为:-91。

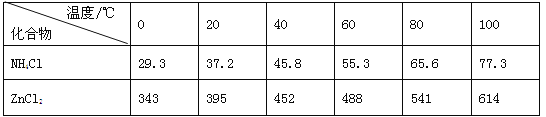
【题目】酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
回答下列问题:
(1)该电池的正极反应式为___,电池反应的离子方程式为___。
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn___g。(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过___分离回收;滤渣的主要成分是MnO2、___和_______,欲从中得到较纯的MnO2,最简便的方法是___,其原理是___。