题目内容
【题目】在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计实验图以确认上述混合气体中有C2H4和SO2 . 回答下列问题: 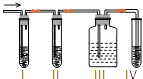
(1)实验室制备乙烯的反应方程式是:
(2)I、Ⅱ、Ⅲ、IV装置可盛放的试剂是I;Ⅱ;Ⅲ;Ⅳ . (将下列有关试剂的序号填入空格内). A.品红溶液 B.NaOH溶液 C.浓硫酸 D.酸性KMnO4溶液
(3)能说明SO2气体存在的现象是 .
(4)使用装置II的目的是 .
(5)使用装置III的目的是 .
(6)确定含有乙烯的现象是 .
【答案】
(1)CH3CH2OH ![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O
(2)A;B;A;D
(3)Ⅰ中品红溶液褪色
(4)除去SO2 , 以免干扰乙烯的检验
(5)检验SO2是否已经被完全除去
(6)Ⅲ中的品红不褪色,Ⅳ中的酸性高锰酸钾溶液褪色
【解析】解:(1)利用乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,乙醇发生了消去反应,反应的化学方程式为:CH3CH2OH ![]() CH2=CH2↑+H2O, 故答案为:CH3CH2OH
CH2=CH2↑+H2O, 故答案为:CH3CH2OH ![]() CH2=CH2↑+H2O;(2)检验二氧化硫用品红溶液,检验乙烯用高锰酸钾酸性溶液,乙烯和二氧化硫都能使高锰酸钾酸性溶液褪色,所以先检验二氧化硫,然后检验乙烯,同在检验乙烯之前用NaOH溶液除尽SO2 , 再通过品红溶液不褪色确认SO2已除干净,最后用高锰酸钾酸性溶液褪色检验乙烯,因装置I用来检验SO2 , 试管中品红溶液褪色,说明含有SO2 , 装置II试管装有NaOH溶液除去SO2 , 装置III试管通过品红溶液不褪色确认SO2已除干净,装置IV 通过高锰酸钾酸性溶液褪色检验乙烯,
CH2=CH2↑+H2O;(2)检验二氧化硫用品红溶液,检验乙烯用高锰酸钾酸性溶液,乙烯和二氧化硫都能使高锰酸钾酸性溶液褪色,所以先检验二氧化硫,然后检验乙烯,同在检验乙烯之前用NaOH溶液除尽SO2 , 再通过品红溶液不褪色确认SO2已除干净,最后用高锰酸钾酸性溶液褪色检验乙烯,因装置I用来检验SO2 , 试管中品红溶液褪色,说明含有SO2 , 装置II试管装有NaOH溶液除去SO2 , 装置III试管通过品红溶液不褪色确认SO2已除干净,装置IV 通过高锰酸钾酸性溶液褪色检验乙烯,
故答案为:A;B;A;D;(3)装置I用来检验SO2 , 试管中品红溶液褪色,说明含有SO2 ,
故答案为:Ⅰ中品红溶液褪色;(4)装置Ⅱ试管装有NaOH溶液,目的是除去SO2 , 以免干扰乙烯的检验,
故答案为:除去SO2 , 以免干扰乙烯的检验;(5)装置Ⅲ试管通过品红溶液不褪色,从而确定SO2已除干净,
故答案为:检验SO2是否已经被完全除去;(6)装置Ⅳ通过高锰酸钾酸性溶液褪色检验乙烯,如果Ⅲ中的品红不褪色,Ⅳ中的酸性高锰酸钾溶液褪色,则证明有乙烯生成,
故答案为:Ⅲ中的品红不褪色,Ⅳ中的酸性高锰酸钾溶液褪色.
(1)实验室制备乙烯所用的原料为乙醇,浓硫酸作催化剂、脱水剂,反应条件是加热到170℃,据此写出反应的化学方程式;(2)多种产物需检验时,应考虑先后顺序,本题中先检验二氧化硫,然后除去二氧化硫,再检验产物中有乙烯;(3)根据二氧化硫能漂白品红检验二氧化硫的存在;(4)氢氧化钠溶液能吸收二氧化硫,据此可以除去混合气体中的二氧化硫;(5)品红溶液不褪色确认SO2已除干净,避免二氧化硫对乙烯检验的干扰;(6)装置Ⅲ中确定无二氧化硫,装置Ⅳ中气体与酸性高锰酸钾溶液褪色证明混合气体中含有乙烯.

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案


