题目内容
【题目】能量是国民经济发展的重要基础,天然气是我国目前使用的主要能源。
(1)已知
化学键 | C-H | C=O | O=O | H-O |
E/(KJ/mol) | a | b | c | d |
CH4(g)+2O2(g)=CO2(g)+2H2O(g)的焓变ΔH=______kJ/mol。
(2)燃料电池具有高的发电效率,因而受到重视。下图甲为甲烷燃料电池(电解质溶液为硫酸)该电池的正极反应为_________。
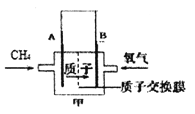
(3)利用上述燃料电池,按下图所示装置进行电解,A、B、C、D均为铂电极,
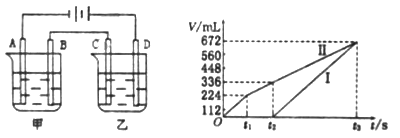
I.甲槽中有200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如上图所示(气体体积已换算成标准状况下的体积),(电解前后溶液的体积变化关系忽略不计)
①原混合溶液中NaCl的物质的量浓度__________mol/L。
②t2时所得溶液的pH=________。
Ⅱ.乙槽中为足量的AgNO3溶液。则阳极反应为__________。t3时电解结束,为了使溶液恢复原样,则可以在反应后的溶液中加入______(填化学式)。
【答案】 (4a+2c-2b-4d) O2+4e-+4H-=2H2O 0.1mol/L pH=1 4OH--4e-=O2+2H2O或2H2O-4e-=O2+4H+ Ag2CO3或Ag2O
【解析】(1)反应热等于断键吸收的能量和形成化学键所放出的能量的差值,则根据键能可知反应CH4(g)+2O2(g)=CO2(g)+2H2O(g)的焓变ΔH=(4a+2c-2b-4d)kJ/mol。(2)正极氧气得到电子,由于存在质子交换膜,则该电池的正极反应为O2+4e-+4H-=2H2O;(3)I、电解200mL一定浓度的NaCl与CuSO4混合溶液,阳极发生2Cl--2e-=Cl2↑、4OH--4e-=O2↑+2H2O,阴极发生Cu2++2e-=Cu、2H++2e-=H2↑,结合图可知,Ⅰ为阴极气体体积与时间的关系,Ⅱ为阳极气体体积与时间的关系,①由图可知,产生氯气为224mL,则由2Cl--2e-=Cl2↑可知,n(NaCl)=(0.224L÷22.4L/mol)×2=0.02mol,所以c(NaCl)=0.02mol÷0.2L=0.1mol/L,t2时生成氧气为112mL,n(O2)=0.112L÷22.4L/mol=0.005mol,则产生氢离子是0.005mol×4=0.02mol,氢离子浓度是0.02mol÷0.2L=0.1mol/L,则pH=1;Ⅱ、乙槽中为足量的AgNO3溶液,则阳极为氢氧根失去电子,反应为4OH--4e-=O2↑+2H2O。由于生成物是硝酸、银和氧气,则t3时电解结束,为了使溶液恢复原样,则可以在反应后的溶液中加入Ag2CO3或Ag2O。

 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案【题目】某实验小组研究溶液中AgNO3和Na2S的反应。
实验 | 试剂 | 现象 | |
| 试管 | 滴管 | |
(pH = 4) |
(pH = 9) | 出现黑色沉淀 | |
(1)用离子方程式解释Na2S溶液pH > 7的原因:________。
(2)实验小组同学认为黑色沉淀中可能含有Ag2O、Ag2S或Ag,设计实验验证。
已知:i.浓硝酸能将Ag2S转化为![]() 和
和![]() ;
;
ii.Ag2O能溶解在浓氨水中形成银氨溶液,而Ag2S和Ag均不能。
① 设计并实施如下实验,证实沉淀中含有Ag2S。

试剂1和试剂2分别是_________、_________。
现象1和现象2分别是_________、_________。
② 设计并实施如下实验,证实沉淀中不含有Ag2O,将实验操作和现象补充完整。
实验操作 | 实验现象 | |
步骤i | 取少量银氨溶液,向其中滴加盐酸 | 出现白色沉淀 |
步骤ii | 取少量洗涤后的黑色沉淀,____________ | ____________ |
③ 经检验,沉淀不含有Ag。

(3)实验小组同学认为AgNO3溶液具有氧化性,在一定条件下能够氧化Na2S,设计实验进行研究(实验装置如右图所示),测得电压为a(![]() )。
)。
对AgNO3溶液中氧化![]() 的物质进行推测:
的物质进行推测:
假设1: ![]() 的AgNO3溶液中
的AgNO3溶液中![]() 氧化了
氧化了![]() ;
;
假设2: ![]() 的AgNO3溶液中
的AgNO3溶液中![]() 氧化了
氧化了![]() 。
。
利用右图装置继续研究(已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大)。
① 将![]() 的AgNO3溶液替换为_______溶液,记录电压为b(
的AgNO3溶液替换为_______溶液,记录电压为b(![]() )。
)。
② 上述实验证实了氧化![]() 的物质中一定包含
的物质中一定包含![]() ,其证据是______。
,其证据是______。
实验结论:AgNO3溶液与Na2S溶液的反应类型与反应条件有关。