题目内容
【题目】燃煤和汽车尾气是造成空气污染产生雾霾的原因之一。消除汽车尾气是减少城市空气污染的热点研究课题。
(1)已知:①N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
②CO(g)+1/2 O2(g)=CO2 (g) △H=-283kJ·mol-1
则汽车尾气中NO和CO在催化转化器中相互反应成无污染的气体的热化学方程式是__________。
(2)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。

已知当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在图中画出c(CO2)在T2、S2条件下达到平衡过程的变化曲线_____________。
(3)在一定温度下,将2.0mol NO、2.4mol气体CO 通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如右图所示:

①有害气体NO的转化率为________, 0~15min NO的平均速率v(NO)=______mol/(L·min)。(保留两位有效数字)
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是________(选填序号)。
a.缩小容器体积b.增加CO的量 c.降低温度 d.扩大容器体积
③若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,化学平衡将___________移动(选填“向左”、“向右”或“不”),移动后在达到平衡时的平衡常数的值是____________(保留两位有效数字)。
【答案】 2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5kJmol-1  40% 0.027mol/(Lmin) cd 向左 0.14
40% 0.027mol/(Lmin) cd 向左 0.14
【解析】试题分析:(1)根据盖斯定律计算汽车尾气中NO和CO在催化转化器中相互反应生成无污染气体的焓变;(2)催化剂能加快化学反应速率,不能使平衡发生移动,平衡时CO2的浓度与T2、S2相同;(3)①根据转化率=![]() 计算;根据
计算;根据![]() 计算速率;②根据平衡移动原理分析CO浓度减小的原因;③利用“三段式”计算平衡常数,计算再向容器中充入NO、N2各0.4mol时的Q值,根据Q、K的关系判断平衡移动方向;温度相同,平衡常数不变;
计算速率;②根据平衡移动原理分析CO浓度减小的原因;③利用“三段式”计算平衡常数,计算再向容器中充入NO、N2各0.4mol时的Q值,根据Q、K的关系判断平衡移动方向;温度相同,平衡常数不变;
解析:(1)①N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
②CO(g)+1/2 O2(g)=CO2 (g) △H=-283kJ·mol-1
根据盖斯定律,②×2-①得2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746.5kJmol-1;(2)催化剂能加快化学反应速率,不能使平衡发生移动,平衡时CO2的浓度与T2、S2相同,所以若催化剂的表面积S1>S2, c(CO2)在T2、S2条件下达到平衡过程的变化曲线是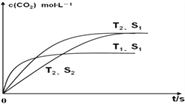 ;
;
(3)根据图像
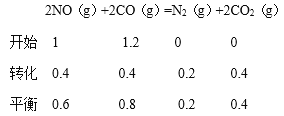
①转化率=![]() =
=![]() ;
; ![]() =
=![]() 0.027mol/(Lmin);②a.缩小容器体积,CO浓度增大,故a错误;b.增加CO的量,CO的浓度一定增大,故b错误; c.降低温度,平衡正向移动,CO浓度减小,故c正确; d.扩大容器体积,CO浓度一定减小,故d正确,选cd;③根据“三段式”,平衡常数
0.027mol/(Lmin);②a.缩小容器体积,CO浓度增大,故a错误;b.增加CO的量,CO的浓度一定增大,故b错误; c.降低温度,平衡正向移动,CO浓度减小,故c正确; d.扩大容器体积,CO浓度一定减小,故d正确,选cd;③根据“三段式”,平衡常数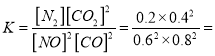 0.14 ,再向容器中充入NO、N2各0.4mol时的Q=
0.14 ,再向容器中充入NO、N2各0.4mol时的Q=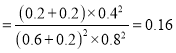 , Q>K,平衡向左移动;温度相同,平衡常数不变,移动后在达到平衡时的平衡常数的值是0.14;
, Q>K,平衡向左移动;温度相同,平衡常数不变,移动后在达到平衡时的平衡常数的值是0.14;

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案【题目】在化学课上老师向NaOH溶液通入CO2后无明显现象。
(提出问题)如何通过实验证明CO2与NaOH发生了反应?
(查阅资料)①碳酸钠溶液中滴加少量的稀盐酸,会先反应生成碳酸氢钠(Na2CO3+HCl=NaHCO3+NaCl)。
②碳酸钠在二氧化碳过量的条件下继续与水和二氧化碳反应生成碱性较弱的碳酸氢钠。
(设计实验)(1)从反应物之一CO2消失的角度,某同学设计了如图所示的实验,打开活塞。向充满CO2的瓶中滴入NaOH溶液,一会儿后观察到的现象是_________,据此判断NaOH与CO2发生了化学反应。但上述实验还不足证明反应,其理由是_______,完善的方案是_______________________________。

(2)从生成物Na2CO3角度,经过讨论,分别设计了以下两个实验方案:
实验操作 | 实验现象 | 结论 |
方案一:向(1)所得的溶液中加入_______溶液 | 有白色沉淀产生 | 有新物质Na2CO3生成,发生反应。 |
方案二:向(1)所得的溶液中滴加过量稀盐酸 | ___________; |
(反思评价)方案二滴加过量稀盐酸的原因是_________。
(实验拓展)该小组同学将过量的干冰放入氢氧化钠溶液中,利用数字化技术测定溶液pH值变化,如图所示,请用化学方程式回答下列问题:

(1)BC段变化原因可能是__________________________;
(2)CD段变化原因可能是__________________________。

