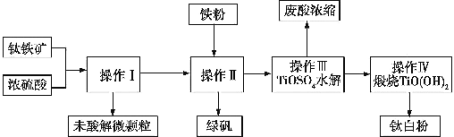
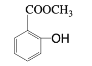
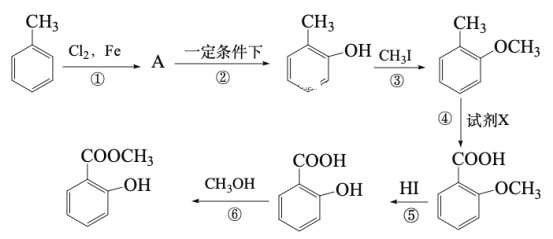
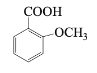
题目内容
【题目】请运用原电池原理设计实验,验证 Cu2+、Fe3+氧化性的强弱。请写出电极反应式。
(1)负极 __________________________
(2)正极 __________________________________
(3)并在方框内画出实验装置图,要求用烧杯和盐桥,并标出外电路中电子流向。________________________________
【答案】Cu2e=Cu2+ 2Fe3++2e=2Fe2+ 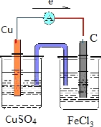
【解析】
Fe3+氧化性比Cu2+强,可发生2Fe3++Cu=2Fe2++Cu2+,反应中Cu被氧化,为原电池的负极,则正极可为碳棒或不如Cu活泼的金属,电解质溶液为氯化铁溶液,正极发生还原反应,负极发生氧化反应,以此解答该题。
Fe3+氧化性比Cu2+强,可发生2Fe3++Cu=2Fe2++Cu2+,
(1)Cu被氧化,为原电池的负极,负极反应为Cu2e=Cu2+;
(2)正极Fe3+被还原,电极方程式为2Fe3++2e=2Fe2+;
(3)正极可为碳棒,电解质溶液为氯化铁,则原电池装置图可设计为 ,电子从铜极流向碳极。
,电子从铜极流向碳极。

【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 | 部分实验现象 |
| a极质量减小,b极质量增加 |
| b极有气体产生,c极无变化 |
| d极溶解,c极有气体产生 |
| 电流计指示在导线中电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c
【题目】下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 将铜粉加入1.0mol/LFe2(SO4)3溶液中 | 溶液变为蓝色 | 金属铁比铜活泼 |
B | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 熔化后的液态铝不滴落下来 | 氧化铝的熔点高于铝的熔点 |
C | 常温下,用pH计测0.1mol/LNaX溶液和0.1mol/LNa2CO3溶液的pH | 前者小于后者 | 酸性:HX>H2CO3 |
D | 向10%的蔗糖溶液中加入少量稀硫酸,水浴加热一段时间,再加入银氨溶液 | 未出现光亮银镜 | 蔗糖未发生水解 |
A. A B. B C. C D. D