题目内容
【题目】一定条件下,容积2L的密闭容器中,将2molL气体和3molM气体混合,发生如下反应:2L(g)+3M(g)![]() xQ(g)+3R(g),10s末,生成2.4molR,测得Q的浓度为0.4mol·L-1。计算:
xQ(g)+3R(g),10s末,生成2.4molR,测得Q的浓度为0.4mol·L-1。计算:
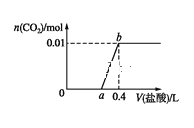
(1)10s末L的物质的量浓度为_________。
(2)前10s内用M表示的化学反应速率为_________。
(3)化学方程式中x值为_________。
(4)L的转化率是_________。
(5)下列还可以说明该反应已达平衡的是_________(填序号)。
①体系内压强不再改变
②容器内气体的密度不再改变
③混合气体的平均相对分子质量不再改变
④v正(M)=2v逆(R)
⑤n(L)∶n(M)∶n(R)=2∶3∶3
(6)在其它条件不变时,减小压强,化学反应反应速率_________(增大、减小、不变)。
【答案】0.2mol·L-1 0.12mol·L-1·s-1 1 80% ①③ 减小
【解析】
结合化学平衡三段式列式计算,根据n=cV计算生成Q的物质的量,结合R的物质的量,利用物质的量之比等于化学计量数之比计算x的值。
经2min达平衡,生成2.4molR,并测得Q的浓度为0.4mol·L-1,则Q转化的物质的量=0.4mol·L-1×2L=0.8mol,转化的物质的量之比等于化学计量数之比,0.8:2.4=x:3,计算得到x=1;
(1)10s末L的物质的量浓度=![]() =0.2mol·L-1,故答案为:0.2mol·L-1;
=0.2mol·L-1,故答案为:0.2mol·L-1;
(2)前10s内用M表示的化学反应速率= =0.12mol·L-1·s-1,故答案为:0.12mol·L-1·s-1;
=0.12mol·L-1·s-1,故答案为:0.12mol·L-1·s-1;
(3)经2min达平衡,生成2.4molR,并测得Q的浓度为0.4mol·L-1,则Q转化的物质的量=0.4mol·L-1×2L=0.8mol,转化的物质的量之比等于化学计量数之比,0.8:2.4=x:3,计算得到x=1,故答案为:1;
(4)L的转化率是![]() ×100%=80%,故答案为:80%;
×100%=80%,故答案为:80%;
(5)①体积减小的反应,体系内压强不再改变,说明已经达到平衡,故正确;
②容器体积不变,气体的质量不变,容器内气体的密度始终不变,容器内气体的密度不再改变,不能说明是否达到平衡,故错误;
③反应前后分子的物质的量发生改变,气体的质量保持不变,混合气体的平均相对分子质量不再改变,说明已经达到平衡,故正确;
④v正(M)=2v逆(R)时,v正(M)与v逆(R)不相等,不等于计量数比1:1,故错误;
⑤n(L)∶n(M)∶n(R)=2∶3∶3,不能确定各组分的浓度是否发生改变,故错误;
故选①③;
(6)在其它条件不变时,减小压强,体积变大,反应混合物的浓度变小,化学反应反应速率减小。故答案为:减小。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
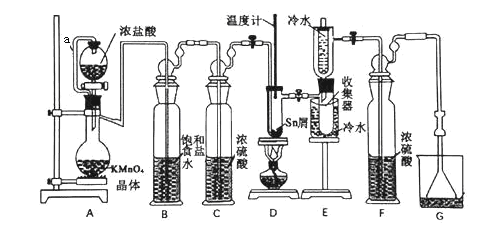
小学生10分钟应用题系列答案【题目】无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂。实验室可用熔融的锡(熔点232℃)与Cl2反应制备SnCl4,装置如下图所示。
已知:①SnCl2、SnCl4有关物理性质如下表
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
②SnCl4遇水极易水解生成SnO2·xH2O。
回答下列问题:
(1)导管a的作用是__________,装置A中发生反应的离子方程式为_____________ 。
(2)当观察到装置F液面上方出现______ 现象时才开始点燃酒精灯,待锡熔化后适当增大氯气流量,继续加热。此时继续加热的目的有两点:加快氯气与锡反应和_________。
(3)若上述装置中缺少装置C(其它均相同),则D处具支试管中发生的主要副反应化学方程式为_______________________________。
(4)Cl2和Sn的反应产物有SnCl4和SnCl2,为了防止产品中带入过多的SnCl2,装置D可改为油浴加热来控制温度,该温度范围是________。
(5)制得的SnCl4产品中常含有SnCl2,可用如下方法测定产品纯度:先准确称量7.60g产品于锥形瓶中,再加过量的FeCl3溶液,发生反应:SnCl2+2FeCl3===SnCl4+2FeCl2,再用0.1000 mol·L—1 K2Cr2O7标准溶液滴定生成的Fe2+,此时还原产物为Cr3+,消耗标准溶液 20.00 mL,则SnCl4产品的纯度为_______________。