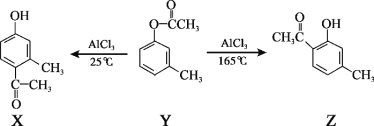
题目内容
【题目】钛铁矿是铁和钛的氧化物矿物,成分可表示为FeTiO3(Ti为+4价)。钛白粉(TiO2)涂料、塑料、油墨、造纸行业具有广泛的用途,制备流程如图:
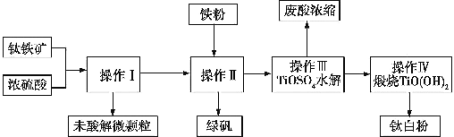
(1)钛铁矿与硫酸反应时可表示为FeTiO3+H2SO4→TiOSO4+X+H2O,其中X的化学式为 ______,该反应为______ (填“氧化还原反应”或“非氧化还原反应”)。
(2)某钛铁矿中FeTiO3的含量为76%,该钛铁矿与硫酸反应时Ti转化率为92%,操作I到操作IV的过程中Ti的转化率为96%,则1t该钛铁矿可生产钛白粉 ______ t(所有计算结果保留两位有效数字),能否计算绿矾的产量______?(若能则计算数值,否则说明理由)。
(3)操作I的名称是 ______,操作II包括搅拌、结晶、______,操作II中加入铁粉的目的是______(用离子方程式表示)。
(4)写出操作III中TiOSO4水解的化学方程式: ______ 。
(5)该生产过程中产生的尾气SO2、SO3的处理方法是 ______ 。
【答案】FeSO4 非氧化还原反应 0.35 在制备钛白粉的过程中没有给出钛铁矿与硫酸的反应,在操作Ⅰ和操作Ⅱ中Fe的转化率也是未知的,故不能计算绿矾的产量 过滤 过滤 Fe+2Fe3+=3Fe2+ TiOSO4+2H2O=TiO(OH)2↓+H2SO4 用碱液吸收
【解析】
(1)根据原子守恒可确定X的化学式,根据反应前后元素的化合价是否发生改变判断反应是否为氧化还原反应;
(2)根据元素守恒得:FeTiO3~TiO2,利用FeTiO3在反应过程中的利用率来计算二氧化钛的质量;在制备钛白粉的过程中没有给出钛铁矿与硫酸的反应,在操作Ⅰ和操作Ⅱ中Fe的转化率也未知,因此不能计算绿矾的产量;
(3)从溶液中得到了没有与酸反应的颗粒状物质故所需的操作为过滤;从溶液中得到晶体的操作为结晶后过滤;铁粉与可能生成的+3价的铁离子反应生成+2价的亚铁离子;
(4)根据水解原理:TiOSO4水解时SO42-结合水电离的H+,TiO2+结合水电离的OH-来书写方程式;
(5)因SO2、SO3是酸性氧化物,可以和碱液之间反应,据此解答。
钛铁矿与硫酸反应:FeTiO3+H2SO4=TiOSO4+FeSO4+H2O,然后过滤出未被酸溶解的物质,向所得到的滤液中加入铁粉可以得到了绿矾,将滤液控制在一定的条件,使TiOSO4发生水解:TiOSO4+2H2O=TiO(OH)2↓+H2SO4,将过滤出的沉淀进行煅烧,可以得到钛白粉TiO2。
(1)根据原子守恒可知X的化学式为FeSO4,在FeTiO3中Ti为+4价,O为-2价,Fe为+2价,反应前后所有元素的化合价都没有发生改变,因此反应为非氧化还原反应;
(2)假设得到TiO2的质量是m,则根据元素守恒得关系式:FeTiO3~TiO2。则二者转化的质量关系为152~~80,某钛铁矿中FeTiO3的含量为76%,该钛铁矿与硫酸反应时Ti转化率为92%,操作I到操作IV的过程中Ti的转化率为96%,则1t该钛铁矿中含有FeTiO3的质量为1t×76%×92%×96%,假设反应产生的TiO2质量为m,则![]() =
=![]() ,解得m=0.35t;由于在制备钛白粉的过程中没有给出钛铁矿与硫酸的反应,在操作Ⅰ和操作Ⅱ中Fe的转化率也未知,因此不能计算反应产生的绿矾的产量;
,解得m=0.35t;由于在制备钛白粉的过程中没有给出钛铁矿与硫酸的反应,在操作Ⅰ和操作Ⅱ中Fe的转化率也未知,因此不能计算反应产生的绿矾的产量;
(3)在操作I从溶液中得到了没有与酸反应的颗粒状物质,则所需继续的操作为过滤;在操作II加入铁粉后得到了绿矾,应是从溶液中得到晶体的操作为结晶后再过滤;在操作II加入铁粉的目的是为了防止在制备过程中钛铁矿+2价的铁生成+3价的铁使制备的绿矾中含有杂质,故应加入铁粉与生成的+3价的铁反应生成+2价的铁,反应的离子方程式为:Fe+2Fe3+=3Fe2+;
(4)TiOSO4水解时SO42-结合水电离的H+,TiO2+结合水电离的OH-,故反应方程式为:TiOSO4+2H2O=TiO(OH)2↓+H2SO4;
(5)因SO2、SO3都是酸性氧化物,能够与碱反应产生可溶性盐,所以应用碱液进行吸收。

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案