题目内容
【题目】硫代硫酸钠(Na2S2O3)是环保部门监测有害气体常用的一种药品,它易溶于水,遇酸易分解。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图。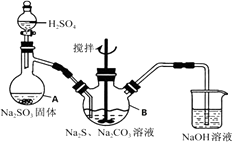
实验具体操作步骤为:
①打开分液漏斗使硫酸慢慢滴下,适当调节分液漏斗的滴速,使反应产生的SO2气体较均匀的通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸。
②直至析出的浑浊不再消失,并控制溶液的pH接近7时,停止通入SO2气体。
(1)写出仪器A的名称。
(2)写出A中发生反应的化学方程式。
(3)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是。
(4)Na2S2O3常用作脱氯剂,在溶液中易被Cl2氧化成SO42离子,该反应的离子方程式为。
(5)为了验证固体硫代硫酸钠工业产品中含有碳酸钠,选用下图装置进行实验。
①实验装置的连接顺序依次是(填装置的字母代号),装置C中的试剂为。
②能证明固体中含有碳酸钠的实验现象是。
【答案】
(1)蒸馏烧瓶
(2)Na2SO3 + H2SO4= Na2SO4+ SO2↑ + H2O
(3)SO2过量,溶液呈酸性,硫代硫酸钠分解,产量下降
(4)S2O32-+4Cl2+5H2O = 2SO42-+8Cl-+10H+
(5)ADCB,品红溶液(或高锰酸钾溶液),C中品红不褪色(或高锰酸钾溶液不褪色),B中石灰水变浑浊
【解析】解析:(1)仪器A的名称蒸馏烧瓶。
(2)A中硫酸与亚硫酸钠反应生成硫酸钠、二氧化硫、水的化学方程式是Na2SO3 + H2SO4= Na2SO4+ SO2↑ + H2O。
(3)SO2过量,溶液呈酸性,硫代硫酸钠遇酸易分解产量下降,所以实验中通入的SO2不能过量。
(4)Na2S2O3常用作脱氯剂,在溶液中易被Cl2氧化成SO42离子,反应的离子方程式为S2O32-+4Cl2+5H2O = 2SO42-+8Cl-+10H+。
(5) 硫代硫酸钠与硫酸反应生成二氧化硫;碳酸钠与硫酸反应生成二氧化碳,要验证二氧化碳生成需先用高锰酸钾溶液除去二氧化硫、用品红验证二氧化硫是否除尽、用澄清石灰水检验二氧化碳。①实验装置的连接顺序依次是ADCB,C装置中盛放品红溶液检验二氧化硫是否除尽;②C中品红不褪色、B中石灰水变浑浊能证明固体中含有碳酸钠。

【题目】镁及其化合物用途非常广泛,目前世界上60%的镁是从海水中提取.从海水中先将海水淡化获得淡水和浓海水,浓海水的主要成分如下:
离子 | Na+ | Mg2+ | Cl﹣ | SO42﹣ |
浓度/(gL﹣1) | 63.7 | 28.8 | 144.6 | 46.4 |
再利用浓海水提镁的一段工艺流程如下图:
请回答下列问题
(1)浓海水主要含有的四种离子中物质的量浓度最小的是 . 在上述流程中,可以循环使用的物质是 .
(2)在该工艺过程中,X试剂的化学式为 .
(3)“一段脱水”目的是制备MgCl22H2O;“二段脱水”的目的是制备电解原料.若将MgCl26H2O直接加热脱水,则会生成Mg(OH)Cl.若电解原料中含有Mg(OH)Cl,电解时Mg(OH)Cl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率.生成MgO的化学方程式为 .
(4)若制得Mg(OH)2的过程中浓海水的利用率为80%,由Mg(OH)2至“二段脱水”制得电解原料的过程中镁元素的利用率为90%,则1m3浓海水可得“二段脱水”后的电解原料质量为g.
(5)以LiCl﹣KCl共熔盐为电解质的Mg﹣V2O5电池是战术导弹的常用电源,该电池的总反应为:Mg+V2O5+2LiCl MgCl2+V2O4Li2O 该电池的正极反应式为 .
(6)Mg合金是重要的储氢材料.2LiBH4/MgH2体系放氢焓变示意图如下,则: Mg(s)+2B(s) MgB2(s)△H= . 
【题目】温度为T时,在4.0L恒容密闭容器中充入2.0mol PCl5 , 发生反应:PCl5(g)PCl3(g)+Cl2(g),反应时间(t)与容器内气体总压强(p)的数据见表:
t/s | 0 | 50 | 150 | 250 | 350 |
总压强p/100kPa | 100 | 116 | 119 | 120 | 120 |
(1)由总压强p和起始压强p0计算反应物PCl5的转化率α(PCl5)的表达式为?平衡时PCl5的转化率为多少?
(2)反应在前50s的平均速率v(PCl3)为多少?
(3)该温度下的平衡常数为多少?